Bakar oksid
Cuprum (Cu) se odnosi na broj nisko-aktivnih metala. Karakterizira ga stvaranje kemijskih spojeva s stupnjevima oksidacije +1 i +2. Na primjer, dva oksida, je spoj dvaju elemenata Cu i O kisik: oksidacija država +1 - bakrov oksid CU2O a oksidacijsko stanje + 2 - bakar oksid CuO. Unatoč tome što se sastoje od istih kemijskih elemenata, ali svaki od njih ima svoje posebne karakteristike. U hladnoći, metal reagira vrlo slabo s kisikom zraka, pokriva se s bakrenim oksidnim filmom, koji sprečava daljnju oksidaciju šupljine. Kada se zagrije, ova jednostavna tvar s rednim brojem 29 u Mendelejevom stolu potpuno je oksidirana. Nadalje, nastaje bakreni (II) oksid: 2Cu + O2 → 2CuO.
sadržaj
Dušični oksid je smećkasto-crvena krutina s molarnom masom od 143.1 g / mol. Spoj ima talište od 1235 ° C, vrelište od 1800 ° C. Ne otapa se u vodi, već se otapa u kiselinama. Bakarni (I) oksid je razrijeđen u otopinu amonijaka (Koncentrirana), tvoreći kompleks bezbojno [Cu (NH3) 2] +, koji se lako oksidira na zraku amonijak kompleks plavo-ljubičasta boja [Cu (NH3) 4 (H2O) 2] 2+ otopi u klorovodičnoj kiselini da se formira CuCl2. U povijesti fizike poluvodiča, Cu2O je jedan od najcjenjenijih materijala.
Bakreni oksid (I), također poznat kao hemioxid, ima osnovna svojstva. Može se dobiti oksidacija metala: 4Cu + O2 → 2 Cu20. Dodatke poput vode i kiselina utječu na brzinu ovog procesa, kao i daljnju oksidaciju u dvovalentni oksid. Bakarni oksid se može otopiti sumporna kiselina, čime nastaje čisti metal i sol: H2SO4 + Cu20 → Cu + CuS04 + H20. U sličnoj shemi, oksid reagira s stupnjem oksidacije metala +1 s drugim kiselinama koje sadrže kisik. Kada hemioxid reagira sa kiselinama koji sadrže halogen, formiraju se monovalentne metalne soli: 2HCl + Cu20 → 2CuCl + H20.
Pronađeno bakar oksid (I) u prirodi kao crvene rude (to staro ime, uz kao rubin Cu), mineralna pod nazivom „kuprit”. Njegovo obrazovanje traje dugo. Može se dobiti umjetno pri visokim temperaturama ili pod visokim tlakom kisika. Dušični obično se koristi kao fungicid, kao pigment, kao podvodni obraštanja agent u boji ili more, a također se koristi kao katalizator.
Međutim, izlaganje ovoj tvari s kemijskom formulom Cu2O na tijelu može biti opasno. Kada se udiše, izaziva otežano disanje, kašalj i ulceracije i perforacije dišnih puteva. Ako se proguta, iritira gastrointestinalni trakt, koji je popraćen povraćanjem, bolovima i proljevom.
Najveći oksid bakra u izgledu je prah od smeđe do crne boje. U prirodi se u čistom obliku pojavljuje kao mineral "Tenorite". Talište je 1326 ° C, vrelište je 2000 ° C. Netopivo je u vodi, alkoholu, amonijev hidroksid, otopina amonij karbonata. Topivo u vodenim otopinama amonij klorida i kalijev cijanid. Ova crna krutina može se dobiti grijanjem Cu u zraku. Međutim, u ovom slučaju, također formira oksid Cu. Priprema CuO bakrenog oksida moguće je zagrijavanjem spojeva:
bakreni (II) nitrat 2Cu (NO3) 2 → 4 NO2 + 022CuO;
bakar (II) hidroksid Cu (OH) 2 → H20 + CuO;
bakar (II) karbonat CuCO3 → CO2 + CuO.
Kuprum (II) oksid je bazičan, pa se otapa u mineralnim kiselinama (klorovodična, sumporna i dušična) kako bi se dobila odgovarajuća dvovalentna Cu sol:
2HCl + CuO → CuCl2 + H20;
H2S04 + CuO → CuS04 + H20;
-
2HNO3 + CuO → Cu (N03) 2 + H20.
Reakcija bakrenog (II) oksida s koncentriranom alkalijom da se dobije sol: 2 KOH + CuO + H20 → K2 [Cu (OH) 4].
Oksid se također može reducirati u metalni Cu reakcijom s vodikom ili ugljični monoksid:
H2 + CuO → Cu + H20;
CO + CuO → Cu + CO2.
Bakar (II) oksid se koristi u keramici (kao pigment) za izradu glazura (plava, zelena i crvena, a ponekad i ružičasta, siva ili crna). Također se koristi kao dodatak prehrani u životinja kako bi se smanjio nedostatak šupljine u tijelu. Ovo je abrazivni materijal koji je neophodan za poliranje optičke opreme. Koristi se za proizvodnju suhih baterija, za proizvodnju drugih Cu soli. CuO spoj se također koristi u zavarivanju legura bakra.
Učinak kemijskog spoja CuO također može biti opasno za ljudsko tijelo. Udisanje izaziva iritaciju pluća. Bakar (II) oksid može izazvati groznicu metalnih para (MFF). Cu oksid izaziva obezbojenje kože, može doći do problema s vidom. Kada se proguta, poput hemioxida, dovodi do trovanja, što je popraćeno simptomima u obliku povraćanja i boli.
 Magnezijev oksid: svojstva, proizvodnja, primjena
Magnezijev oksid: svojstva, proizvodnja, primjena Priprema aldehida i njihovih reakcija
Priprema aldehida i njihovih reakcija Barij oksid
Barij oksid Kemija: oksidi, njihova klasifikacija i svojstva
Kemija: oksidi, njihova klasifikacija i svojstva Koja je priroda oksida
Koja je priroda oksida Viši volfram oksid
Viši volfram oksid Kloroksid
Kloroksid Sumporni oksid
Sumporni oksid Fosforni oksid
Fosforni oksid Reakcije smanjenja oksidacije
Reakcije smanjenja oksidacije Natrijev oksid
Natrijev oksid Silicij oksid
Silicij oksid Kromov oksid
Kromov oksid Kiseli oksidi: kratki opis skupine
Kiseli oksidi: kratki opis skupine Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje
Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje Kalcijev oksid. Fizička, toplinska i kemijska svojstva. Primjena.
Kalcijev oksid. Fizička, toplinska i kemijska svojstva. Primjena. Osnovni oksidi i njihova svojstva
Osnovni oksidi i njihova svojstva Dušična kiselina. Kemijska i fizikalna svojstva
Dušična kiselina. Kemijska i fizikalna svojstva Cinkov oksid. Svojstva i aplikacije
Cinkov oksid. Svojstva i aplikacije Oksidi, oksidi koji formiraju natrij i koji ne stvaraju soli
Oksidi, oksidi koji formiraju natrij i koji ne stvaraju soli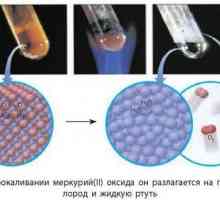 Oksidi. Primjeri, klasifikacija, svojstva
Oksidi. Primjeri, klasifikacija, svojstva
 Kemija: oksidi, njihova klasifikacija i svojstva
Kemija: oksidi, njihova klasifikacija i svojstva Koja je priroda oksida
Koja je priroda oksida Viši volfram oksid
Viši volfram oksid