Koja je priroda oksida
Razgovarajmo o tome kako odrediti prirodu oksida. Za početak, sve tvari su podijeljene u dvije skupine: jednostavne i složene. Jednostavne tvari su podijeljene na metale i nefemale. Kompleksni spojevi podijeljeni su u četiri klase: baze, okside, soli, kiseline.

definicija
Budući da priroda oksida ovisi o njihovom sastavu, prvo dajemo definiciju ove klase anorganskih tvari. Oksidi su složene tvari, koje se sastoje od dva elementa. Njihova je osobitost da se kisik uvijek nalazi u formuli drugi (zadnji) element.
Najčešća opcija je interakcija s kisikom jednostavnih tvari (metali, nonmetali). Na primjer, interakcija magnezija s kisikovim oblicima magnezijev oksid, pokazujući osnovna svojstva.

nomenklatura
Priroda oksida ovisi o njihovom sastavu. Postoje određena pravila koja takve tvari nazivaju.
Ako je oksid formiran metalima glavnih podskupina, valencija nije indicirana. Na primjer, kalcijev oksid CaO. Ako se u spoju prvo nalazi metal slične podskupine, koji ima varijabilnu valenciju, tada mora biti označen rimskim brojem. Ubaci se nakon naziva veze u zagradama. Na primjer, postoje željezni oksidi (2) i (3). Prilikom sastavljanja formula oksida, treba imati na umu da zbroj stupnjeva oksidacije u njemu treba biti nula.

klasifikacija
Razmotrimo kako priroda oksida ovisi o stupnju oksidacije. Metali koji imaju oksidacijsko stanje od +1 i +2 tvore glavne okside s kisikom. Specifična značajka takvih spojeva je osnovna priroda oksida. Takvi spojevi ulaze u kemijsku interakciju s oksidima ne-metala koji tvore soli, stvarajući soli s njima. Osim toga, bazični oksidi reagiraju s kiselinama. Proizvod interakcije ovisi o količini u kojoj su polazni materijali snimljeni.
Nemetali, kao i metali s stupnjevima oksidacije od +4 do +7, formiraju se s oksidima kisika. Priroda oksida uključuje interakciju s bazama (alkalijama). Rezultat interakcije ovisi o količini u kojoj je izvadena izvorna alkalija. Na njegovu nedostatku, kiselinska sol je formirana kao proizvod interakcije. Na primjer, u reakciji ugljikovog monoksida (4) s natrijevim hidroksidom nastaje natrijev hidrogenkarbonat (kisela sol).
U slučaju reakcije kiselog oksida s viškom alkalija, reakcijski produkt je prosječna sol (natrij karbonat). Priroda kiselih oksida ovisi o stupnju oksidacije.
Oni su podijeljeni u oksida formiranje soli (u kojem je stupanj oksidacije elementa jednak broju skupine) kao i neutralnim oksida nisu sposobni za formiranje soli.
Amfoterni oksidi
Također postoji amfoterna svojstva svojstava oksida. Njegova se esencija sastoji u interakciji ovih spojeva s obje kiseline i alkalijama. Koje okside pokazuju dvostruka (amfoterna) svojstva? To uključuje binarne spojeve metala s stupnjem oksidacije +3, kao i oksidima berilijuma, cinka.

Metode dobivanja
Postoje različiti načini dobivanja oksida. Najčešća opcija je interakcija s kisikom jednostavnih tvari (metali, nonmetali). Na primjer, interakcija magnezija s kisikovim oblicima magnezijev oksid, pokazujući osnovna svojstva.
Osim toga, oksidi se također mogu dobiti interakcijom kompleksnih supstanci s molekulskim kisikom. Na primjer, kada se gori pirite (željezo sulfid 2), dva oksida se mogu dobiti odjednom: sumpor i željezo.
Druga mogućnost za pripravu oksida je reakcija razgradnje soli kisika koja sadržavaju kisik. Na primjer, pri raspadanju kalcijevog karbonata, moguće je dobiti ugljični dioksid i kalcijev oksid (Quick vapno).
Osnovni i amfoterni oksidi nastaju pri raspadanju netopivih baza. Na primjer, nakon kalcinacije željeznog hidroksida (3), nastaju željezni oksid (3) i vodena para.
zaključak
Oksidi su klasa anorganskih tvari koje imaju široku industrijsku primjenu. Koriste se u graditeljstvu, farmaceutskoj industriji, medicini.
Osim toga, amfoterni oksidi se često koriste u organskoj sintezi kao katalizatori (ubrzivači kemijskih procesa).
 Magnezijev oksid: svojstva, proizvodnja, primjena
Magnezijev oksid: svojstva, proizvodnja, primjena Kemija: oksidi, njihova klasifikacija i svojstva
Kemija: oksidi, njihova klasifikacija i svojstva Kako sastaviti kemijsku jednadžbu: pravila, primjeri. Zapisnik o kemijskoj reakciji
Kako sastaviti kemijsku jednadžbu: pravila, primjeri. Zapisnik o kemijskoj reakciji Anorganske tvari
Anorganske tvari Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari Viši volfram oksid
Viši volfram oksid Kloroksid
Kloroksid Sumporni oksid
Sumporni oksid Klase anorganskih spojeva
Klase anorganskih spojeva Natrijev oksid
Natrijev oksid Kromov oksid
Kromov oksid Amfoterni metali i njihova svojstva
Amfoterni metali i njihova svojstva Kiseli oksidi: kratki opis skupine
Kiseli oksidi: kratki opis skupine Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje
Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje Kalcijev oksid. Fizička, toplinska i kemijska svojstva. Primjena.
Kalcijev oksid. Fizička, toplinska i kemijska svojstva. Primjena. Osnovni oksidi i njihova svojstva
Osnovni oksidi i njihova svojstva Oksidi, oksidi koji formiraju natrij i koji ne stvaraju soli
Oksidi, oksidi koji formiraju natrij i koji ne stvaraju soli Kemijska svojstva soli i postupci za njihovo dobivanje
Kemijska svojstva soli i postupci za njihovo dobivanje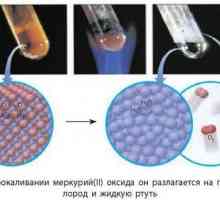 Oksidi. Primjeri, klasifikacija, svojstva
Oksidi. Primjeri, klasifikacija, svojstva Kiseli oksidi uključuju ne-metalne okside: primjeri, svojstva
Kiseli oksidi uključuju ne-metalne okside: primjeri, svojstva Amfoterni hidroksidi su tvari dvostruke prirode
Amfoterni hidroksidi su tvari dvostruke prirode
 Kemija: oksidi, njihova klasifikacija i svojstva
Kemija: oksidi, njihova klasifikacija i svojstva Kako sastaviti kemijsku jednadžbu: pravila, primjeri. Zapisnik o kemijskoj reakciji
Kako sastaviti kemijsku jednadžbu: pravila, primjeri. Zapisnik o kemijskoj reakciji Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari Viši volfram oksid
Viši volfram oksid