Kloroksid
Oksidi ili oksidi su spojevi različitih elemenata s kisikom. Gotovo svi elementi čine takve spojeve. Klor, kao i drugi halogeni, karakterizira takve spojeve pozitivnim oksidacijskim stanjem. Svi oksidi klora su izuzetno nestabilne tvari, što je tipično za okside svih halogena. Četiri tvari su poznate, molekule koje sadrže klor i kisik.
sadržaj
- Plinoviti spoj od žute do crvenkaste s karakterističnim mirisom (poput mirisa plina Cl2) je klorov oksid (I). Formula je kemijski Cl20. Talište minus 116 ° C, vrelište plus 2 ° C U normalnim uvjetima, njegova gustoća iznosi 3,22 kg / msup3-.
- Žuti ili žuto-narančasti plin s karakterističnim mirisom - klor oksid (IV). Kemijska formula ClO2. Točka topljenja minus 59 ° C, vrelište plus 11 ° C.
- Crveno-smeđa tekućina je klor (VI) oksid. Formula je kemijska Cl206. Talište je 3,5 ° C, vrelište plus 203 ° C.
- Bezbojna uljna tekućina - oksid klora (VII). Formula Chemical Cl2O7. Točka tališta je minus 91,5 ° C, vrelište je plus 80 ° C.
Oksid klor oksidacijsko stanje +1 anhidrid slab monobazična hipokloritne kiseline (HCIO). Dobije se postupkom njegovog Peluso živin oksid reakcijom s plinovitim klorom u skladu s jednim od reakcijske jednadžbe: 2Cl2 + 2HgO → Cl2O + Hg2OCl2 ili 2Cl2 + HgO → Cl2O + HgCl2. Uvjeti ovih reakcija su različiti. Klor oksid (I) se kondenzira na temperaturi od minus 60 ° C, jer kod viših temperatura se razgrađuje eksplozivno, te u koncentriranom obliku je eksplozivna. Cl2O vodena otopina dobivena kloriranjem u vodi ili alkalijski karbonati, zemno alkalnim metalima. Oksid otapa u vodi i, naznačen time, da nastaje hipokloritne kiseline: Cl2O + H2O harr- 2HClO. Osim toga, također se otapa u ugljikovom tetrakloridu.
Oksid klora s oksidacijskim stanjem +4 je inače nazvan dioksid. Ova tvar je topljiva u vodi, sumpornoj i octenoj kiselini, acetonitrilu, ugljikovom tetrakloridu, kao i drugim organskim otapalima, s povećanim polarnostima, čija se topljivost povećava. U laboratoriju se dobiva interakcijom kalijev klorat s oksalnom kiselinom: 2KClO3 + H2C2O4 → K2CO3 + 2ClO2 + CO2 + H20. Budući da je klor (IV) oksid eksplozivna tvar, ona se ne može pohraniti u otopinu. Za ove se svrhe upotrebljava silikagel, na čijoj površini, u adsorbiranom obliku, ClO2 se može duže čuvati, a moguće je ukloniti onečišćenje nečistoća iz klora jer se ne apsorbira silika gelom. Pod industrijskim uvjetima, ClO2 se dobiva redukcijom sa sumpornim dioksidom, u prisutnosti sumporne kiseline, natrij klorata: 2NaClO3 + S02 + H2SO4 → 2NaHSO4 + 2ClO2. Koristi se kao bjelilo, na primjer, papir ili celuloza, itd., Kao i za sterilizaciju i dezinfekciju raznih materijala.
Klorov oksid s oksidacijskim stanjem od + 6, raspada se na topljenje reakcijskom jednadžbom: Cl206 → 2ClO3. Klor (VI) oksid se dobiva oksidacijom s ozon dioksidom: 2O3 + 2ClO2 → 2O2 + C206. Ovaj oksid može reagirati s otopinama lužina i vodom. Došlo je do neproporcionalnih reakcija. Na primjer, kada reagiraju s kalijevim hidroksidom: 2KOH + C206 → KClO3 + KClO4 + H20, dobivaju se kloratni i kalijev perklorat kao rezultat.
Viši oksid klor se također naziva anhidrid klora ili dikloroheptaoksid jaki oksidant. Može se puhati ili zagrijavati. Međutim, ova tvar je stabilnija od oksida s oksidacijskim stanjem +1 i +4. Njegova dekompozicija na klor i kisik se ubrza zbog prisutnosti nižih oksida i povećanjem temperature od 60 do 70 ° C. Klorov oksid (VII) se može polako otopiti u hladnoj vodi, što rezultira reakcijom perklorna kiselina: H20 + Cl207 → 2HClO4. Diklorheptoksid se pripremi blago zagrijavanjem perklorne kiseline s fosfornim anhidridom: P4O10 + 2HC104C207 + H2P4O11. Također, Cl207 se može dobiti korištenjem oleuma umjesto anhidrida fosfora.
Dio anorganske kemije koji proučava halogene okside, uključujući okside klora, aktivno se razvija posljednjih godina, jer su ti spojevi energetski intenzivni. Oni su sposobni za komore za sagorijevanje jet motora dati energiju odmah, i kemijski izvori struje može se regulirati brzina njegovog otklona. Drugi razlog za zanimanje je mogućnost sintetiziranja novih skupina anorganskih spojeva, na primjer, kloridni oksid (VII) predak perklorata.
 Što su binarnim vezama?
Što su binarnim vezama? Magnezijev oksid: svojstva, proizvodnja, primjena
Magnezijev oksid: svojstva, proizvodnja, primjena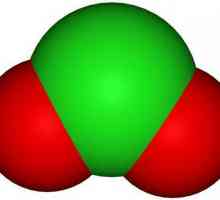 Klor-dioksid: formula, primjena. Učinci kloridnog dioksida na tijelo
Klor-dioksid: formula, primjena. Učinci kloridnog dioksida na tijelo Kemija: oksidi, njihova klasifikacija i svojstva
Kemija: oksidi, njihova klasifikacija i svojstva Što su halogeni? Kemijski elementi fluora, klora, joda i astata
Što su halogeni? Kemijski elementi fluora, klora, joda i astata Koja je priroda oksida
Koja je priroda oksida Viši volfram oksid
Viši volfram oksid Sumporni oksid
Sumporni oksid Fosforni oksid
Fosforni oksid Dušikov dioksid
Dušikov dioksid Bakar oksid
Bakar oksid Natrijev oksid
Natrijev oksid Silicij oksid
Silicij oksid Kromov oksid
Kromov oksid Kiseli oksidi: kratki opis skupine
Kiseli oksidi: kratki opis skupine Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje
Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje Kalcijev oksid. Fizička, toplinska i kemijska svojstva. Primjena.
Kalcijev oksid. Fizička, toplinska i kemijska svojstva. Primjena. Osnovni oksidi i njihova svojstva
Osnovni oksidi i njihova svojstva Dušična kiselina. Kemijska i fizikalna svojstva
Dušična kiselina. Kemijska i fizikalna svojstva Oksidi, oksidi koji formiraju natrij i koji ne stvaraju soli
Oksidi, oksidi koji formiraju natrij i koji ne stvaraju soli Oksidi. Primjeri, klasifikacija, svojstva
Oksidi. Primjeri, klasifikacija, svojstva
 Magnezijev oksid: svojstva, proizvodnja, primjena
Magnezijev oksid: svojstva, proizvodnja, primjena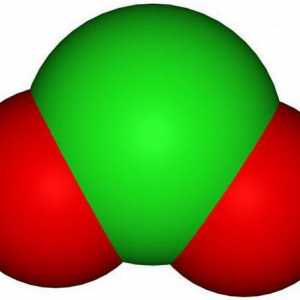 Klor-dioksid: formula, primjena. Učinci kloridnog dioksida na tijelo
Klor-dioksid: formula, primjena. Učinci kloridnog dioksida na tijelo Kemija: oksidi, njihova klasifikacija i svojstva
Kemija: oksidi, njihova klasifikacija i svojstva Što su halogeni? Kemijski elementi fluora, klora, joda i astata
Što su halogeni? Kemijski elementi fluora, klora, joda i astata Koja je priroda oksida
Koja je priroda oksida Viši volfram oksid
Viši volfram oksid