Alkeni: formula. Kemijska svojstva. recepcija
Alkeni su alifatski ugljikovodici čije molekule imaju jednu dvostruku vezu između ugljikovih atoma. Oni se također obično nazivaju olefini (od olefija - ulja) zbog etilen klorida proizvedenog u 18. stoljeću, koja je tekuća uljna tvar. Opća formula alkena
sadržaj
Najjednostavniji alken
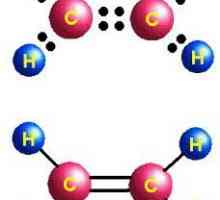
Najjednostavniji predstavnik brojnih alkena je eten (to je etilen). Atomi ugljika u svojoj molekuli su u sp2-hibridno stanje. To znači da u formiranju dvostruke veze u alkenu, jedan S-orbitalni i dva P-orbita sudjeluju.
Svaki ugljikov atom u dvostrukoj vezi ima tri orbita u sp statusu2-hibridizacija i jedan p-orbitali. Kada se preklapaju elektronski oblaci, jedan sigma - komunikacija i jedan pi je veza koja tvori dvostruku vezu. U ovom slučaju, pi - veza je mnogo slabija i pod djelovanjem reagensa lako se slomiti, uzrokujući karakteristična svojstva alkena. Pri tome, onemogućuje okretanje susjednih atoma ugljika oko osi veze.

Molekula etilena ima simetričnu strukturu. Svi atomi su u istoj ravnini, a kutovi između njih su 120 °. Duljina veze C = C iznosi 0,134 nm.
izomera
Alkene su karakterizirane istim tipovima izomerizma kao i za alkane. Ali dodaju još jednu vrstu - prostorno. Zahvaljujući dostupnosti pi su veze, a kao posljedica te krute fiksacije ugljikovih atoma u odnosu jedna na drugu, rotacija duž osi dvostruke veze je nemoguća bez prekida. Međutim, cis-trans izomerizam se opaža kod alkenskih molekula. Karakterizira ga različit raspored supstituenata s obzirom na ravninu pi - veza. To dovodi do razlika u fizičkim i kemijskim svojstvima takvih izomera. Primjeri su trans-buten-2 i cis-buten-2.
Strukturne formule alkena s izomerijom položaja dvostruke veze odlikuju se smještajem C = C u glavnom lancu. Na primjer, u molekuli heksen-2, višestruka veza nalazi se između drugog i trećeg C atoma, te u molekuli heksen-3, između trećeg i četvrtog.
Kada se ugljikov skelet izomerizira, višestruka veza ima isti raspored, međusobno se međusobno raspored ugljikovih atoma u molekulama razlikuje. Stoga, heksen-1 ima linearnu strukturu, a njegov strukturni izomer (2,3-dimetilbuten-l) je razgranat.
Također je karakteristična i izometrija interklasa. Identična opća formula s alkenima je cikloalkani. Na primjer, interclassni izomer buten-1 će biti ciklobutan.

Fizička svojstva
Po svojim fizikalnim svojstvima, alkeni su blizu alkana, a također se uočava određena regularnost kod tališta i vrenja temperatura homogenih etena. Uz rast molekularne mase, tj. Uz produženje ugljikovodičnog lanca, tbale i tpl, kao i gustoće.
Prva tri izraza serije etilena su plinovi koji slijede 13 tekućine, a zatim iz alkena formule C18Eta-36 - krute tvari. Svi olefini su slabo topljivi u vodi, ali su savršeno topljivi u organskim otapalima (poput benzina i benzena). Lakši je od vode.
Kemijska svojstva
Za takve tvari karakteristični su različiti tipovi reakcija. Većina ih je popraćena slomom dvostruke veze koja proizlazi iz interakcije alkena s bilo kojim agensom.
Reakcija dodavanja:
- Hidrogenacija (dodavanje molekule vodika):
SEta-3-Ceta- = CeA-2 + Eta-2 -> CEa-3-SEta-2-SEta-3.
- Halogeniranje (dodavanje halogene molekule - Cl2, br2, F2):
SEta-3-Ceta- = CeA-2 + cl2 -> CEa-3-CEta-Ci-CEta-2Cl.
- Hidracija (dodavanje molekule vode):
SEta-3-Ceta- = CeA-2 + Eta-2О-> СEta-3-C.Eta- (OH) -CH3.
- Hidrokloridiranje (dodavanje molekule vodikovih halida):
SEta-3-Ceta- = CeA-2 + Eta-Cl-> CEA-3-CEta-Ci-SEta-3.
polimerizacija
Reakcija polimerizacije obično se naziva procesom spajanja molekula monomolekula male molekulske mase u veliku polimernu molekulu. Taj je proces uzrokovan različitim čimbenicima, na primjer, promjenom tlaka ili temperature, zračenjem, djelovanjem slobodnih radikala. Polimerizacija alkena također prati poremećaj dvostruke veze, a zbog pojave slobodnih orbitala, susjedne molekule su spojene zajedno. Etilen se proizvodi od polietilena, propen (propilen) je polipropilen.
n CH2= CeA-2 - (-Cta-2 - SEta-2 -)n
n CH2= CH-Cea-3 - (-Cta-2 - Ce- (Cea-3) -)n
Međutim, ne samo etilenski homologi su važni za pripravu polimera, nego također i alkenski derivati formule C2F4 (tetrafluoroetilen), C6H5-CH = CH2 (stiren), CH2= CHCN (akrilonitril), od kojih se dobivaju teflon, polistiren i sintetička vlakna.

oksidacija
Gori. Kao i svi ugljikovodici, alkeni spali s formiranjem CO2 i Eta-2O:
C2Eta-4 + 3O2 -> 2CO2 + 2Eta-2O.
Mekana oksidacija s kalijevim permanganatom je kvalitativna reakcija, budući da je ružičasta boja otopine obojena:
SEta-2= CeA-2 + [O] + Eta-2O -> ETA-O-SEta-2-SEta-2-OEta-.
Katalitička oksidacija koja se koristi u industriji. Na primjer, u prisutnosti PdCl2 i CuCl2 Etilen se oksidira u acetaldehid:
2SEta-2= CeA-2 + oh2 -> 2Ceta-3 - COEta-.
recepcija
Prva četiri predstavnika alkena sa formulama C2Eta-2, C3Eta-6, C4Eta-8 i C5Eta-10 izolirana od plinova nastalih tijekom pucanja i pirolize naftnih produkata, kao i koksnog ugljena:
C7Eta-16 -> C3Eta-6 + C4H10.

Proces dehidrogenacije alkana na povišenoj temperaturi u prisutnosti katalizatora također igra važnu ulogu u industriji:
SEta-3-SEta-2-SEta-3 -> CEa-3-Ceta- = CeA-2 + Eta-2.
U laboratorijima se etilen dobiva zagrijavanjem etilnog alkohola u prisutnosti Al2O3:
CEta-3-CEta-2-OEta- -> CEta-2= CEta-2 + Eta-2O.
 Prvi predstavnik alkena je etilen. Fizička svojstva, proizvodnja, primjena etilena
Prvi predstavnik alkena je etilen. Fizička svojstva, proizvodnja, primjena etilena Formula benzena: koja od varijacija je točna?
Formula benzena: koja od varijacija je točna?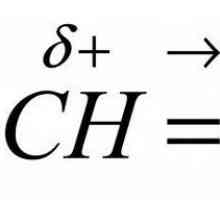 Pravilo Markovnikova V. V. Suština i primjeri
Pravilo Markovnikova V. V. Suština i primjeri Molekularna i strukturna formula fenola
Molekularna i strukturna formula fenola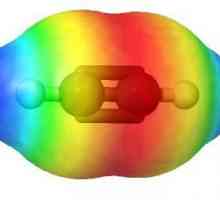 Strukturna i molekulska formula: acetilen
Strukturna i molekulska formula: acetilen Postupci za proizvodnju alkena: laboratorij i industrijski
Postupci za proizvodnju alkena: laboratorij i industrijski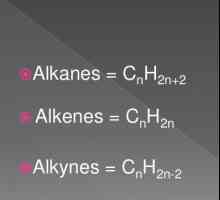 Opća formula alkena. Svojstva i svojstva alkena
Opća formula alkena. Svojstva i svojstva alkena Kako napraviti izomere i homologe? Kako napraviti izomere alkana?
Kako napraviti izomere i homologe? Kako napraviti izomere alkana? Alkadieni su tipični predstavnici nezasićenih ugljikovodika
Alkadieni su tipični predstavnici nezasićenih ugljikovodika Kvalitativne reakcije na alkene. Kemijska svojstva i struktura alkena
Kvalitativne reakcije na alkene. Kemijska svojstva i struktura alkena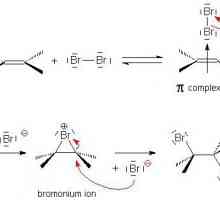 Elektrofilno dodavanje u organskoj kemiji
Elektrofilno dodavanje u organskoj kemiji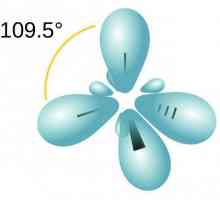 Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije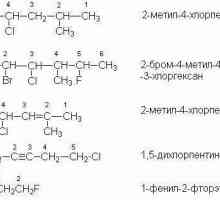 Što je sustavna nomenklatura
Što je sustavna nomenklatura Što su alifatski ugljikovodici?
Što su alifatski ugljikovodici? Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva
Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva Serije homologije
Serije homologije Nezasićeni ugljikovodici: alkeni, kemijska svojstva i primjena
Nezasićeni ugljikovodici: alkeni, kemijska svojstva i primjena Alkanes: kemijska svojstva
Alkanes: kemijska svojstva Kemijska svojstva alkena (olefina)
Kemijska svojstva alkena (olefina)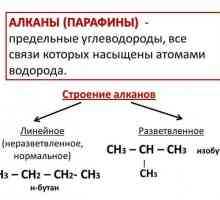 Proizvodnja alkana i njihovih svojstava
Proizvodnja alkana i njihovih svojstava Strukturna formula je grafički prikaz tvari
Strukturna formula je grafički prikaz tvari
 Formula benzena: koja od varijacija je točna?
Formula benzena: koja od varijacija je točna?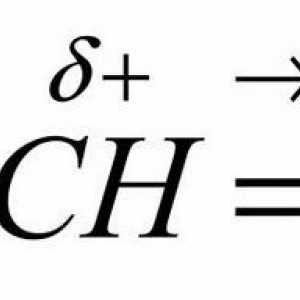 Pravilo Markovnikova V. V. Suština i primjeri
Pravilo Markovnikova V. V. Suština i primjeri Molekularna i strukturna formula fenola
Molekularna i strukturna formula fenola Strukturna i molekulska formula: acetilen
Strukturna i molekulska formula: acetilen Postupci za proizvodnju alkena: laboratorij i industrijski
Postupci za proizvodnju alkena: laboratorij i industrijski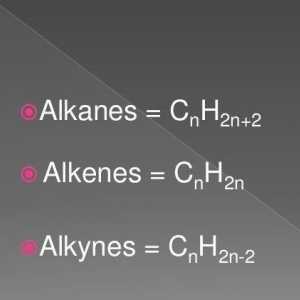 Opća formula alkena. Svojstva i svojstva alkena
Opća formula alkena. Svojstva i svojstva alkena Kako napraviti izomere i homologe? Kako napraviti izomere alkana?
Kako napraviti izomere i homologe? Kako napraviti izomere alkana? Alkadieni su tipični predstavnici nezasićenih ugljikovodika
Alkadieni su tipični predstavnici nezasićenih ugljikovodika Kvalitativne reakcije na alkene. Kemijska svojstva i struktura alkena
Kvalitativne reakcije na alkene. Kemijska svojstva i struktura alkena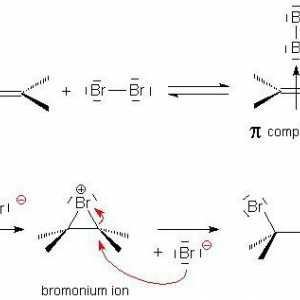 Elektrofilno dodavanje u organskoj kemiji
Elektrofilno dodavanje u organskoj kemiji