Opća formula alkena. Svojstva i svojstva alkena
Najjednostavniji organski spojevi su ograničavajući i nezasićeni ugljikovodici. Oni uključuju tvari alkanskog razreda, alkini, alkeni.
sadržaj

Njihove formule uključuju vodik i atome ugljika u određenom slijedu i količini. Često se nalaze u prirodi.
Definicija alkena
Drugi naziv su olefini ili etilen ugljikovodici. Ovo je ime ove klase spojeva u 18. stoljeću kada je otvorena uljna tekućina minus-etilen klorid.
Alkeni uključuju tvari koje se sastoje od vodika i ugljikovih elemenata. Oni se odnose na acikličke ugljikovodike. U njihovoj molekuli postoji jedna dvostruka (nezasićena) veza koja povezuje dva atoma ugljika jedan s drugim.
Formule alkena
Svaka klasa spojeva ima svoju kemijsku oznaku. U njima simboli elemenata periodičkog sustava upućuju na sastav i strukturu veze svake tvari.
Opća formula alkena označena je kako slijedi: CnH2n, gdje je broj n veći ili jednak 2. Kod dešifriranja jasno je da za svaki atom ugljika postoje dva vodikova atoma.
Molekularne formule alkena iz homologne serije predstavljene su slijedećim strukturama: C2H4, C3H6,C4H8, C5H10, C6H12, C7H14, C8H16, C9H18, C10H20. Može se vidjeti da svaki slijedeći ugljikovodik sadrži još jedan ugljik i još dva vodika.
Postoji grafička oznaka mjesta i redoslijeda kemijskih spojeva između atoma u molekuli, koja pokazuje strukturnu formu alkena. Upotrebom valentne crtice označava vezu ugljika na vodik.
Alkenska strukturnu formulu može se prikazati u ekspandiranom obliku, kada se prikazuju svi kemijski elementi i veze. S više konciznim izrazom olefina, veza ugljik-vodik nije prikazana s valencijskim crticama.
Skeletna formula je najjednostavnija struktura. Slomljena linija predstavlja osnovu molekule u kojoj su ugljikovi atomi predstavljeni njegovim vrhovima i krajevima, a veze označavaju vodik.
Kako se formiraju imena olefina
Polazeći od sustavne nomenklature, alkenske formule i njihova imena čine sastav alkana koji pripadaju krajnjim ugljikovodicima. Za to, u ime posljednjeg sufiksa -an zamijenjen je -ilenom ili -enom. Primjer je formiranje butilena iz butana i pentena iz pentana.
Za označavanje položaja veze, dvostruka veza s ugljikovim atomima označena je arapskim brojem na kraju naziva.
Ime alkena temelji se na označavanju ugljikovodika s najdužim lancem u kojem je prisutna dvostruka veza. Obično se odabire kraj brojčanog lanca, koji je najbliži nezasićenoj skupini ugljikovih atoma.
Ako strukturnu formu alkena ima grane, onda navedite imena radikala i njihov broj, a prije njih stavite brojeve koji odgovaraju mjestu u lancu ugljika. Tada slijedi naziv ugljikovodika. Nakon što se brojevi obično stavljaju crticu.
Postoje nezasićene radikalne grane. Njihova imena mogu biti trivijalna ili formirana prema pravilima sustavne nomenklature.
Na primjer, HNS = CH- se naziva etenil ili vinil.
izomeri
Molekularne formule alkena ne mogu označavati izomerizam. Međutim, za ovu klasu tvari, s izuzetkom molekule etilena, inherentna je prostornu modifikaciju.
Izomeri etilenskih ugljikovodika mogu biti duž ugljikovog kostura, položaja nezasićenih veza, interklasa ili prostornog.
Opća formula alkena određuje broj atoma ugljika i vodika u lancu, ali ne pokazuje prisutnost i mjesto dvostruke veze. Primjer je ciklopropan kao interklasni izomer C3H6 (Propilen). drugo vrste izomerizma očitati u C4H8 ili buten.
Položaj nezasićene veze različit je za buten-1 ili buten-2, u prvom slučaju dvostruki spoj je blizu prvog ugljikovog atoma, au drugoj - usred lanca. Izomerizam ugljikovog kostura može se uzeti u obzir primjerom metilnog propena (CH3-C (CH3) = CH2) i izobutilen ((CH3) 2C = CH2).
Prostorna modifikacija je svojstvena butenu-2 u trans i cis položaju. U prvom slučaju, bočni radikali nalaze se na vrhu i na dnu glavnog ugljikovog lanca s dvostrukom vezom, u drugom izomeru supstituenti na istoj strani.
Karakteristike olefina
Opća formula alkena određuje fizičko stanje svih predstavnika ove klase. Polazeći od etilena i završava s butilenom (iz C2 do C4), tvari postoje u plinovitom obliku. Tako bezbojni eten ima slatki miris, malu topljivost u vodi, a molekularna masa manja od one zraka.
U tekućem obliku, ugljikovodici homolognog praga od C5 do C17. Polazeći od alkena koji ima 18 ugljikovih atoma u glavnom lancu, fizičko stanje se mijenja u čvrsti oblik.
Svi olefini smatraju se slabim u vodenim medijima, ali su dobri u otapalima organske prirode, kao što je benzen ili benzin. Njihova molekularna masa je manja od one vode. Povećanje lanca ugljika dovodi do povećanja karakteristika temperature pri taljenju i ključanju tih spojeva.
Svojstva olefina
Strukturna formula alkena pokazuje prisutnost u kosturu dvostruke veze iz pi - i sigma - spojeva dva atoma ugljika. Ova struktura molekule određuje njezina kemijska svojstva. Link-pi- smatra se ne jako jakim, što ga čini moguće uništiti stvaranjem novih dviju veza-sigma-, koje se dobivaju kao rezultat dodavanja par atoma. Nezasićeni ugljikovodici su donatori elektrona. Sudjeluju u elektrofilnim procesima spajanja.
Važna kemijska svojstva svih alkena je postupak halogeniranja, uz izolaciju spojeva slično dihalogeniranim spojevima. Halogeni atomi mogu biti vezani dvostrukom vezom na ugljik. Primjer je bromiranje propilena s tvorbom 1,2-dibrompropana:
H2C = CH-CH3 + br2 → BrCH2sramežljiva - CHBr-CH3.
Ovaj proces neutralizacije boje u bromovom vodom alkeni se smatra kvalitativnim dokazom postojanja dvostruke veze.
Važne reakcije uključuju hidrogeniranje oligina uz dodavanje molekule vodika pod djelovanjem katalitičkih metala kao što su platina, paladij ili nikal. Kao rezultat toga, dobiveni su zasićeni ugljikovodici. Formule alkana, alkena dane su niže u reakciji hidrogeniranja butena:
CH3-CH2-CH = CH2 + H2 ni→ CH3-CH2-CH2-CH3.
Zove se postupak pričvršćivanja molekula vodikovog halida u olefine
Hidrohalogeniranje, prolazak prema pravilu kojeg je otkrio Markovnikov. Primjer je hidrobrominacija propilena da nastane 2-brompropan. U njemu, vodik se kombinira s dvostrukom vezom s ugljikom, koji se smatra najhidrogeniranijim:
CH3-CH = CH2 + HBr → CH3-BrCH CH3.
Reakcija dodavanja alkena pod djelovanjem kiselina naziva se hidratacijom. Rezultat je molekula propanol-2 alkohola:
CH3-HC = CH2 + H2O → CH3-OHCH CH3.
Kada je izložen alkenima sumpornom kiselinom, dolazi do procesa sulfonacije:
CH3-HC = CH2 + HOminus-OSOminus-OH → CH3-CH3CH-Ominus-SO2minus-OH.
Reakcija nastaje da se dobiju kiselinski esteri, na primjer izopropilsulfatna kiselina.
Alkeni su osjetljivi na oksidaciju tijekom njihovog sagorijevanja s djelovanjem kisika uz stvaranje vode i ugljičnog dioksida:
2CH3-HC = CH2 + 9o2 → 6CO2 + 6H2O.
Interakcija olefinskih spojeva i razrijeđenog kalijevog permanganata u obliku otopine dovodi do stvaranja glikola ili alkohola diatomske strukture. Ova reakcija je također oksidativna s formiranjem etilen glikola i obezbojenjem otopine:
3H2C = CH2 + 4H2O + 2KMnO4 3OHCH-CHOH + 2MnO2 +2KOH.
Alkenove molekule mogu biti uključene u proces polimerizacije s mehanizmom slobodnog radikala ili kation-aniona. U prvom slučaju, pod utjecajem peroksida, dobiva se polimer tipa polietilena.
Prema drugom mehanizmu, kationski katalizatori su kiseline, a anionske tvari su organometalne tvari s izolacijom stereoselektivnog polimera.
Što su alkani
Oni se također nazivaju parafini ili ograničavaju acikličke ugljikovodike. Imaju ravnu ili razgranatu strukturu koja sadrži samo zasićene jednostavne veze. Svi zastupnici homologne serije ove klase imaju opću formulu CnH2n + 2.
One sadrže samo atome ugljika i vodika. Opća formula alkena oblikovana je od oznake krajnjih ugljikovodika.
Imena alkana i njihovih svojstava
Najjednostavniji predstavnik ovog razreda je metan. Slijede tvari poput etana, propana i butana. U srcu je njihova imena korijen brojeva na grčkom jeziku, na koji je dodan sufiks -an. Nazivi alkana navedeni su u IUPAC nomenklaturi.
Opća formula alkena, alkina, alkana uključuje samo dvije vrste atoma. To uključuje elemente ugljika i vodika. Broj ugljikovih atoma u sve tri klase podudara se, razlika se promatra samo u količini vodika koji se može odvojiti ili pričvrstiti. Zasićeni ugljikovodici daju nezasićene spojeve. Parafini u molekuli sadrže još dva vodikova atoma od olefina, što je potvrđeno općom formulom alkana, alkena. Struktura alkena smatra se nezasićenima zbog prisutnosti dvostruke veze.
Ako usporedimo broj voshy-doshy-roshy-dnyh i ugshy-lešij-roshy-dnyh atoshy-mov u alshy-kashy-pokušaja, vrijednost će makshy-sishy-malshy NYM u usporedbi s ostalim klasama ugshy-lešij-voshy-doshy -roshy-Ing.
Polazeći od metana i završavanjem butanom (iz C1 do C4), tvari postoje u plinovitom obliku.
U tekućem obliku, ugljikovodici homolognog praga od C5 do C16. Polazeći od alkana koji ima 17 ugljikovih atoma u glavnom lancu, fizičko stanje se mijenja u čvrsti oblik.
Karakterizira ih izomerizam duž ugljikovog kostura i optičkih modifikacija molekule.
Parafina-ugljik vashy lentshy-noshy-sti smatrati potpuno zashy-nyashy-tymi susjedni ugshy-lešij-roshy dashy-E-ili-voshy doshy-roshy-dashy-E kako bi se dobilo vezu sigma - tip. Sa hishy-mishy-cheshy-tion točke gledišta, to uzrokuje njihove slabosti svoyshy-tion, što je razlog zašto alkani zovu preshy-delshy-nyshy-a ili nashy-syshy-schenshy-nyshy je ugshy-lešij-voshy-doshy-roshy- Dov nedostaje afinitet.
Ulaze u reakcije supstitucije povezane s radikalnim halogeniranjem, sulfokloriranjem ili nitracijom molekule.
Parafini podliježu oksidaciji, sagorijevanju ili raspadanju pri visokim temperaturama. Pod djelovanjem akceleratora reakcije dolazi do razdvajanja atoma vodika ili dehidrogenacije alkana.
Što su alkini
Oni se također nazivaju acetilenskim ugljikovodicima, u kojima je trostruka veza prisutna u ugljikovom lancu. Struktura alkina opisana je općom formulom CnH2n-2. To pokazuje da za razliku od alkana, acetilenski ugljikovodici nedostaju četiri atoma vodika. Zamjenjuju se trostrukom vezom koju čine dva pi-- spojeva.
Takva struktura određuje kemijska svojstva određene klase. Strukturna formula alkena i alkina jasno pokazuje nezasićenost njihovih molekula, kao i prisutnost dvostrukog (H2C꞊CH2) i trostruku (HCequiv-CH) vezu.
Naziv alkina i njihovih svojstava
Najjednostavniji predstavnik je acetilen ili HCequiv-CH. Također se zove ethyne. Dolazi iz naziva zasićenog ugljikovodika, u kojem je uklonjen sufiks -an i dodan je -in. U imenima dugih alkinima, znamenka označava mjesto trostruke veze.
Znajući strukturu zasićenih i nezasićenih ugljikovodika mogu se odrediti na temelju slovo označava Opća formula alkina: a) CnH2n- a) CnH2n + 2 c) CnH2n-2) r CnH2n-6. Točan odgovor je treća opcija.
Polazeći od acetilena i završava s butanom (iz C2 do C4), tvari su plinovite u prirodi.
U tekućem obliku postoje ugljikovodici homolognog praznine od C5 do C17. Počevši s alkinom koji ima 18 ugljikovih atoma u glavnom lancu, fizičko stanje se mijenja u čvrsti oblik.
Oni su karakterizirani izomerijom duž ugljikovog kostura, položaju trostruke veze, a također i izmjenama molekula molekula.
Prema njihovim kemijskim svojstvima, acetilenski ugljikovodici su slični alkenima.
Ako alkin ima terminalnu trostruku vezu, onda oni djeluju kao kiselina da bi formirale alkinske soli, na primjer NaCequiv-CNa. Prisutnost dva pi - vezanje čini molekulu acetilidina natrija snažnim nukleofilom koji ulazi u reakciju supstitucije.
Acetilen se klorira u prisutnosti bakrenog klorida, kako bi se dobio dikloracetil kondenzacije pod djelovanjem haloalkinil otpuštanjem diacetylenic molekula.
Alkini sudjeluju u elektrofilnim reakcijama vezivanja, čiji je princip temelj halogeniranja, hidrolize, hidrotiranja i karbonilacije. Međutim, takvi su procesi slabiji nego kod alkena s dvostrukom vezom.
Za acetilenske ugljikovodike moguće su reakcije dodavanja preko nukleofilnog tipa alkoholne molekule, primarnog amina ili sumporovodika.
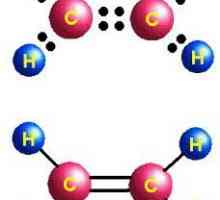 Prvi predstavnik alkena je etilen. Fizička svojstva, proizvodnja, primjena etilena
Prvi predstavnik alkena je etilen. Fizička svojstva, proizvodnja, primjena etilena Formula benzena: koja od varijacija je točna?
Formula benzena: koja od varijacija je točna? Strukturna i molekulska formula: acetilen
Strukturna i molekulska formula: acetilen Postupci za proizvodnju alkena: laboratorij i industrijski
Postupci za proizvodnju alkena: laboratorij i industrijski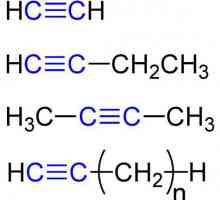 Kemijska svojstva alkina. Struktura, prijem, primjena
Kemijska svojstva alkina. Struktura, prijem, primjena Kako napraviti izomere i homologe? Kako napraviti izomere alkana?
Kako napraviti izomere i homologe? Kako napraviti izomere alkana?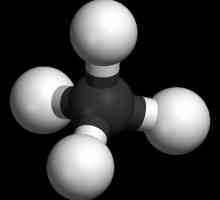 Alkadieni su tipični predstavnici nezasićenih ugljikovodika
Alkadieni su tipični predstavnici nezasićenih ugljikovodika Kvalitativne reakcije na alkene. Kemijska svojstva i struktura alkena
Kvalitativne reakcije na alkene. Kemijska svojstva i struktura alkena Što su aromatski ugljikovodici: formula, svojstva
Što su aromatski ugljikovodici: formula, svojstva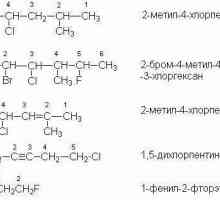 Što je sustavna nomenklatura
Što je sustavna nomenklatura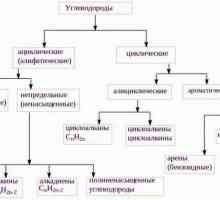 Što su alifatski ugljikovodici?
Što su alifatski ugljikovodici? Organski spojevi i njihova klasifikacija
Organski spojevi i njihova klasifikacija Kemijska svojstva alkana
Kemijska svojstva alkana Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva
Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva Serije homologije
Serije homologije Nezasićeni ugljikovodici: alkeni, kemijska svojstva i primjena
Nezasićeni ugljikovodici: alkeni, kemijska svojstva i primjena Alkanes: kemijska svojstva
Alkanes: kemijska svojstva Kemijska svojstva alkena (olefina)
Kemijska svojstva alkena (olefina)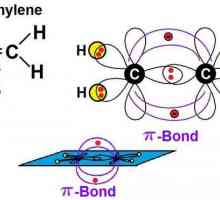 Alkeni: formula. Kemijska svojstva. recepcija
Alkeni: formula. Kemijska svojstva. recepcija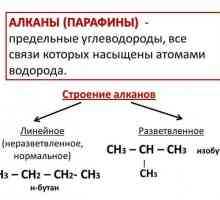 Proizvodnja alkana i njihovih svojstava
Proizvodnja alkana i njihovih svojstava Strukturna formula je grafički prikaz tvari
Strukturna formula je grafički prikaz tvari
 Formula benzena: koja od varijacija je točna?
Formula benzena: koja od varijacija je točna? Strukturna i molekulska formula: acetilen
Strukturna i molekulska formula: acetilen Postupci za proizvodnju alkena: laboratorij i industrijski
Postupci za proizvodnju alkena: laboratorij i industrijski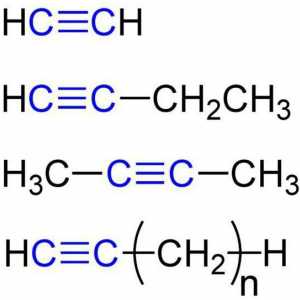 Kemijska svojstva alkina. Struktura, prijem, primjena
Kemijska svojstva alkina. Struktura, prijem, primjena Kako napraviti izomere i homologe? Kako napraviti izomere alkana?
Kako napraviti izomere i homologe? Kako napraviti izomere alkana? Alkadieni su tipični predstavnici nezasićenih ugljikovodika
Alkadieni su tipični predstavnici nezasićenih ugljikovodika Kvalitativne reakcije na alkene. Kemijska svojstva i struktura alkena
Kvalitativne reakcije na alkene. Kemijska svojstva i struktura alkena Što su aromatski ugljikovodici: formula, svojstva
Što su aromatski ugljikovodici: formula, svojstva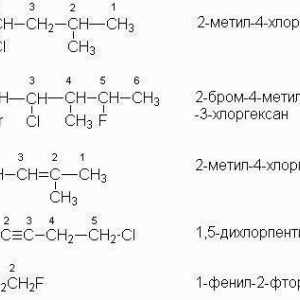 Što je sustavna nomenklatura
Što je sustavna nomenklatura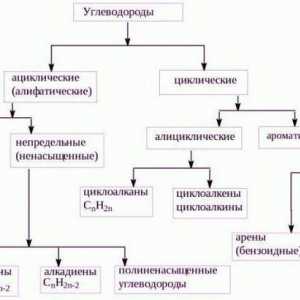 Što su alifatski ugljikovodici?
Što su alifatski ugljikovodici?