Formula kisika. Periodni sustav Mendelejeva - kisika
sadržaj
- Kalkogeni su povezani s elementima kisika
- Kisik je najčešći element
- Struktura kisikovog atoma
- Svojstva kisika - kemijski element
- Kisik je jednostavna tvar
- Fizička svojstva
- Dobivanje kisika u laboratoriju
- Spaljivanje
- Proizvodnja kisika na industrijskoj razini
- Kemijski proračuni prema formuli i reakcijske jednadžbe koje uključuju molekule o2
- Uloga molekula o2 u prirodi i ljudskom životu
- Kisik je idealan oksidator
Kalkogeni su povezani s elementima kisika
Slični atomi su jedna grupa u periodičkom sustavu. Kisik vodi obitelj kalkogena, ali se razlikuje od njih u brojnim svojstvima.

Atomska masa kisika - predak skupine - je 16 a. Kalkogeni u formiranju spojeva s vodikom i metalima pokazuju uobičajeno stanje oksidacije: -2. Na primjer, u vodi (H2O) oksidacijski broj kisika je -2.
Sastav tipičnih vodikovih spojeva kalcogena odgovara općoj formuli: H2R. Kada se te tvari rastope, nastaju kiseline. Samo vodikov spoj kisika i vode ima posebna svojstva. Prema riječima znanstvenika, ova neobična tvar je vrlo slaba kiselina i vrlo slaba baza.

Sumpor, selen i telurij imaju tipična pozitivna oksidacijska stanja (+4, +6) u spojevima s kisikom i drugim ne-metalima koji imaju visoku elektronsku zastupljenost (EO). Sastav kalcijevog oksida odražava opće formule: RO2, RO3. Odgovarajuće kiseline imaju sastav: H2RO3, H2RO4.
Elementi odgovaraju jednostavnim tvarima: kisikom, sumporom, selenom, telurima i polonijem. Prva tri predstavnika pokazuju nemetalna svojstva. Formula kisika je O2. Alotropna modifikacija istog elementa je ozon (O3). Obje izmjene su plinovi. Sumpor i selen su čvrsti nemetali. Telurij je metaloidna tvar, dirigent električne struje, polonij je metal.
Kisik je najčešći element
Ukupni sadržaj elementarnih atoma u zemljinoj kori je približno 47% (težinski). Kisik se nalazi u slobodnom obliku, iu sastavu brojnih spojeva. Jednostavna tvar čija je formula O2, nalazi se u atmosferi, u iznosu od 21% zraka (po volumenu). Molekularni kisik se otopi u vodi, koji se nalazi između čestica tla.
Već znamo da postoji druga vrsta postojanja istog kemijskog elementa u obliku jednostavne supstance. Ovaj ozon je plin koji se formira na visini od oko 30 km od površine zemlje slojem, koji se često naziva ozonski omotač. Vezani kisik ulazi u molekule vode, u mnoge stijene i minerale, organske spojeve.

Struktura kisikovog atoma
Periodni sustav Mendelejeva sadrži potpune podatke o kisiku:
- Serijski broj elementa je 8.
- Napunjenost jezgre je +8.
- Ukupan broj elektrona je 8.
- Elektronička formula kisika je 1s22s22p4.
U prirodi postoje tri stabilna izotopa koji imaju isti redni broj u periodičnom stolu, isti sastav protona i elektrona, ali različit broj neutrona. Izotopi su označeni istim simbolom, O. Za usporedbu, dajemo dijagram koji odražava sastav triju izotopa kisika:

Svojstva kisika - kemijski element
Na 2p podrazini atom ima dva nesparen elektrona, što objašnjava pojavu oksidacije -2 i + 2. Dva paru elektroni ne mogu isključiti, da je stupanj oksidacije povećan na četiri kao sumporom i drugim chalcogenides. Razlog je nedostatak slobodnog podmora. Stoga, u spojevima, kisik kemijskog elementa ne pokazuje stupanj valencije i oksidacije jednak broju skupine u kratkoj verziji periodičkog sustava (6). Uobičajeni oksidativni broj je -2.
Samo u spojevima s fluorom, kisik pokazuje ne-karakteristično pozitivno stanje oksidacije od +2. EO vrijednost dva različita snaga nemetala: EA (d) = 3,5 EE (F) = 4. Kao još elektronegativnog element fluor jači zadržava svoj valentni elektroni i privlači čestica na vanjskom nivou energije atoma kisika. Stoga, u reakciji s fluorom, kisik je reducirajući agens, daje elektrone.

Kisik je jednostavna tvar
Engleski istraživač D. Priestley u 1774, tijekom eksperimenta, izolirani plin u raspadanju žive oksida. Dvije godine ranije K. Sheele je dobila istu tvar u čistom obliku. Samo nekoliko godina kasnije francuski kemičar A. Lavoisier utvrdio je da je za plin dio zraka, proučavao je svojstva. Kemijska formula kisika je O2. U zapisu kompozicije tvari odražavamo elektrone koji sudjeluju u formiranju nepolarne kovalentne veze - O :: O. Zamijenimo svaki par obvezujućih elektrona jednim redom: 0 = 0. Ova formula kisika jasno pokazuje da su atomi u molekuli povezani između dva zajednička para elektrona.

Izvršavamo jednostavne izračune i određujemo koja je relativna molekularna masa kisika: G. (O.2) = Ar (O) x2 = 16 x 2 = 32. Za usporedbu: Mr (zrak) = 29. Kemijska formula za kisik razlikuje se od ozonskog formata za jedan atom kisika. Stoga, g. (O3) = Ar (O) x3 = 48. Ozon je 1,5 puta teži od kisika.
Fizička svojstva
Kisik je plin bez boje, okusa i mirisa (pri običnoj temperaturi i atmosferskom tlaku). Tvar je nešto teža od zraka, otapa se u vodi, ali u malim količinama. Točka taljenja kisika je negativna vrijednost i iznosi -218.3 ° C. Točka u kojoj se tekući kisik ponovno pretvara u plinovitu je njezina točka vrenja. Za molekule O2 vrijednost ove fizičke količine doseže -182.96 ° C. U tekućem i krutom stanju, kisik dobiva svijetloplavu boju.
Dobivanje kisika u laboratoriju
Kada zagrije, koji sadrži kisik, kao što su tvari kalijev permanganat, dodjeljuje se bezbojno plin koji može izolirati u tikvici i cijevi. Ako u čistog kisika unesete osvijetljenu zraku, onda gori sjajnije nego u zraku. Dvije druge laboratorijske metode za dobivanje kisika - razgradnja vodikovog peroksida i kalijevog klorata (sol pažljive soli). Razmotrimo shemu uređaja koji se koristi za toplinsku dekompoziciju.

U ispitnoj cijevi ili balonu s okruglim dnom, potrebno je uliti malo Bertholet soli, zatvoriti čep s izlazom plina. Njezin suprotni kraj bi trebao biti poslan (pod vodom) u balon naopačke. Vrat bi trebao biti spušten u širok staklo ili kristalizator ispunjen vodom. Kada se epruveta s Bertolet solom grije, kisik se oslobađa. Na plinskoj cijevi ulazi u tikvicu, istiskujući vodu iz njega. Kada je tikvica napunjena plinom, zatvorena je čepom pod vodom i okrenuta. Kisik dobiven u ovom laboratorijskom eksperimentu može se koristiti za proučavanje kemijskih svojstava jednostavne tvari.
spaljivanje
Ako laboratorij gori tvari u kisiku, onda morate znati i pridržavati se propisa o vatri. Vodik odmah gori u zraku, i pomiješan s kisikom u omjeru 2: 1, to je eksplozivno. Izgaranje tvari u čistom kisiku događa se mnogo intenzivnije nego u zraku. Taj se fenomen objašnjava sastavom zrak. Kisik u atmosferi je nešto više od 1/5 dijela (21%). Izgaranjem - reakciji tvari s kisikom, a što rezultira različitim proizvodima, uglavnom oksida metala i nemetala. Mješavine opasne po vatri O2 s gorivim tvarima, osim toga, dobiveni spojevi mogu biti toksični.
Izgaranje konvencionalne svijeće (ili podudaranja) praćeno je stvaranjem ugljičnog dioksida. Sljedeće iskustvo može se provoditi kod kuće. Ako je tvar gorjeti pod staklenku ili veliku šalicu, izgaranje prestaje nakon svega kisik konzumira. Dušik ne podržava disanje i paljenje. Ugljični dioksid, oksidacijski produkt, više ne reagira s kisikom. transparentan vapnena voda omogućuje otkrivanje prisutnosti ugljični dioksid nakon spaljivanja svijeća. Ako prolazite kroz proizvode izgaranja kalcijevim hidroksidom, otopina postaje mutna. Postoji kemijska reakcija između vapnenačke vode i ugljičnog dioksida, što rezultira netopivim kalcijevim karbonatom.

Proizvodnja kisika na industrijskoj razini
Najjeftiniji proces, koji rezultira molekulama bez zraka, O2, nije povezan s provođenjem kemijskih reakcija. Recimo, u industriji, na metalurškim postrojenjima, tekućina zraka na niskoj temperaturi i visokom tlaku. Takve važne komponente atmosfere, kao dušik i kisik, vriju na različitim temperaturama. Odvojite smjesu zraka postupnim zagrijavanjem do normalne temperature. Prvo se odvajaju molekule dušika, zatim kisik. Metoda razdvajanja temelji se na različitim fizikalnim svojstvima jednostavnih tvari. Formula za jednostavnu stvar kisika je ista kao prije rashlađivanja i tekućeg zraka, - O2.
Kao rezultat nekih reakcija elektrolize, kisik se također oslobađa, prikuplja se iznad odgovarajuće elektrode. Plin je potreban industrijskim, građevinskim tvrtkama u velikim količinama. Potreba za kisikom stalno raste, posebno kemijska industrija to treba. Dobiveni plin pohranjuje se u industrijske i medicinske svrhe u čeličnim cilindrima opremljenim označavanjem. Kapaciteti s kisikom obojani su plavom ili plavom kako bi ih razlikovali od ostalih ukapljenih plinova - dušika, metana, amonijaka.

Kemijski proračuni prema formuli i reakcijske jednadžbe koje uključuju molekule O2
Numerička vrijednost molarne mase kisika podudara se s drugom vrijednošću - relativnom molekularnom masom. Samo u prvom slučaju postoje mjerne jedinice. Ukratko, formula za tvar kisika i njezinu molarnu masu treba napisati na sljedeći način: M (O2) = 32 g / mol. U normalnim uvjetima, molim da bilo koji plin odgovara volumenu od 22,4 litre. Dakle, 1 mol O2 Je 22,4 litara tvari, 2 mol O2 - 44,8 litara. Izjednačenjem reakcije između kisika i vodika, vidljivo je da 2 mola vodika i 1 mola kisika djeluju u interakciji:

Ako 1 mola vodika sudjeluje u reakciji, volumen kisika će biti 0,5 mola • 22,4 l / mol = 11,2 l.
Uloga molekula O2 u prirodi i ljudskom životu
Oksigen se konzumiraju živi organizmi na Zemlji i sudjeluje u cirkulaciji tvari preko 3 milijarde godina. To je glavna tvar za disanje i metabolizam, pomaže razgraditi molekule hranjivih tvari, sintetizira energiju potrebnu za organizme. Kisik se konstantno konzumira na Zemlji, ali njegove su zalihe nadopunjene zahvaljujući fotosintezi. Ruski znanstvenik K. Timiryazev vjerovao je da zahvaljujući ovom procesu još uvijek postoji život na našem planetu.

Uloga kisika u prirodi i gospodarstvu je velika:
- apsorbira se u procesu disanja živim organizmima;
- sudjeluje u reakcijama fotosinteze u biljkama;
- dio je organskih molekula;
- procesi propadanja, fermentacije, hrđe se javljaju uz sudjelovanje kisika, koji djeluje kao oksidator;
- Koristi se za dobivanje vrijednih proizvoda organske sinteze.
Tekući kisik u cilindrima koristi se za rezanje i zavarivanje metala pri visokim temperaturama. Ti se postupci provode u postrojenjima za strojogradnju, prijevoznim i građevinskim poduzećima. Za obavljanje posla pod vodom, pod zemljom, na velikoj nadmorskoj visini u prostoru bez zraka, ljudi također trebaju molekule O2. Jastuci kisika Koriste se u medicini kako bi obogatili sastav zraka koji udahnu bolesni ljudi. Plin u medicinske svrhe razlikuje se od tehničkih gotovo potpuni nedostatak stranih nečistoća, mirisa.

Kisik je idealan oksidator
Poznati su spojevi kisika sa svim kemijskim elementima periodičkog stola, osim prvog predstavnika plemićkih plinskih plemića. Mnoge tvari izravno reagiraju s O atomima, osim halogena, zlata i platine. Od velike važnosti su fenomeni koji uključuju kisik, koji su praćeni oslobađanjem svjetla i topline. Takvi procesi se široko koriste u svakodnevnom životu, industriji. U metalurgiji, interakcija ruda s kisikom naziva se prženje. Pre-slomljena ruda se miješa sa zrakom obogaćenom kisikom. Na visokim temperaturama, metali se regeneriraju od sulfida do jednostavnih tvari. Zato dobijte željezo i neke obojene metale. Prisutnost čistog kisika povećava brzinu tehnoloških procesa u različitim granama kemije, inženjerstva i metalurgije.
Pojava jeftine metode dobivanja kisika iz zraka metodom odjeljivanja u komponente pri niskim temperaturama potaknula je razvoj mnogih područja industrijske proizvodnje. Kemisti smatraju molekule O2 i O atoma s idealnim oksidacijskim sredstvima. To su prirodni materijali, oni se stalno obnavljaju u prirodi, ne zagađuju okoliš. Osim toga, kemijske reakcije koje uključuju kisik najčešće rezultiraju sintezom druge prirodne i sigurne tvari - voda. Uloga O2 u neutralizaciji toksičnih industrijskih otpada, pročišćavanje vode od onečišćenja. Uz kisik, njegova alotropna modifikacija - ozon - koristi se za dezinfekciju. Ova jednostavna tvar ima visoku oksidativnu aktivnost. Kada ozoniziraju vodu, zagađivači se raspadaju. Ozon također ima štetan učinak na patogene mikroflore.
 Molekula vodika: promjer, formula, struktura. Koja je masa molekule vodika?
Molekula vodika: promjer, formula, struktura. Koja je masa molekule vodika? Što se sastoji od vode: od kojih molekule i atomi
Što se sastoji od vode: od kojih molekule i atomi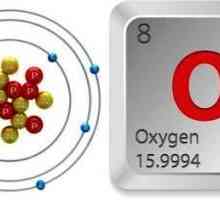 Alotropne modifikacije kisika: komparativna svojstva i vrijednost
Alotropne modifikacije kisika: komparativna svojstva i vrijednost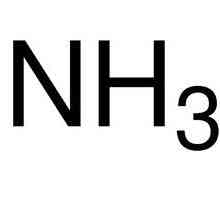 Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata Fizička svojstva aldehida
Fizička svojstva aldehida Molarna masa kisika. Koja je molarnu masu kisika?
Molarna masa kisika. Koja je molarnu masu kisika?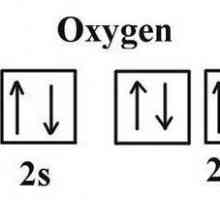 Koja je kisika kisika u spojevima?
Koja je kisika kisika u spojevima? Karakteristike sumpora. Primjena sumpora. Medicinski sumpor
Karakteristike sumpora. Primjena sumpora. Medicinski sumpor Ozon (kemijski element): svojstva, formula, oznaka
Ozon (kemijski element): svojstva, formula, oznaka Koji je stupanj oksidacije kisika? Valencija i stupanj oksidacije kisika
Koji je stupanj oksidacije kisika? Valencija i stupanj oksidacije kisika Periodni sustav: klasifikacija kemijskih elemenata
Periodni sustav: klasifikacija kemijskih elemenata Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari Najlakši plinovi. Značajke vodika, kisika i dušika
Najlakši plinovi. Značajke vodika, kisika i dušika Nemetali su ...? Svojstva ne-metala
Nemetali su ...? Svojstva ne-metala Reakcije smanjenja oksidacije
Reakcije smanjenja oksidacije Klase anorganskih spojeva
Klase anorganskih spojeva Jednostavne tvari
Jednostavne tvari Kemijska i fizikalna svojstva, primjena i proizvodnja kisika
Kemijska i fizikalna svojstva, primjena i proizvodnja kisika Kisik pokazuje pozitivan oksidacijski status u vezi sa što?
Kisik pokazuje pozitivan oksidacijski status u vezi sa što? Kemijska svojstva vodika. Važnost vodika u prirodi
Kemijska svojstva vodika. Važnost vodika u prirodi Kemijski element je vrsta atoma s istim nuklearnim nabojem
Kemijski element je vrsta atoma s istim nuklearnim nabojem
 Što se sastoji od vode: od kojih molekule i atomi
Što se sastoji od vode: od kojih molekule i atomi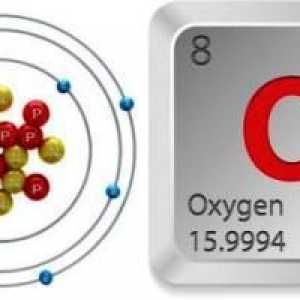 Alotropne modifikacije kisika: komparativna svojstva i vrijednost
Alotropne modifikacije kisika: komparativna svojstva i vrijednost Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata Molarna masa kisika. Koja je molarnu masu kisika?
Molarna masa kisika. Koja je molarnu masu kisika?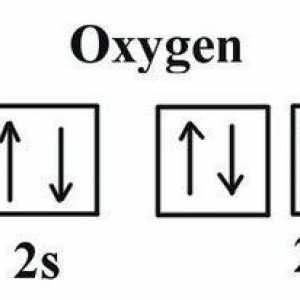 Koja je kisika kisika u spojevima?
Koja je kisika kisika u spojevima? Karakteristike sumpora. Primjena sumpora. Medicinski sumpor
Karakteristike sumpora. Primjena sumpora. Medicinski sumpor Ozon (kemijski element): svojstva, formula, oznaka
Ozon (kemijski element): svojstva, formula, oznaka Koji je stupanj oksidacije kisika? Valencija i stupanj oksidacije kisika
Koji je stupanj oksidacije kisika? Valencija i stupanj oksidacije kisika Periodni sustav: klasifikacija kemijskih elemenata
Periodni sustav: klasifikacija kemijskih elemenata