Alotropne modifikacije kisika: komparativna svojstva i vrijednost
Atomi jedne vrste mogu biti dio različitih tvari. Za element označen simbolom "O" (latinskog naziva Oxygenium), poznate su dvije uobičajene jednostavne tvari. Formula jednog od njih je O2
sadržaj
Što je alotropno modifikacija?
Mnogi kemijski elementi mogu postojati u dva, tri ili više oblika. Svaka od tih modifikacija je formirana od atoma iste vrste. Znanstvenik J. Berzellius 1841. prvi je nazvao takav fenomen alotropijom. Otvorena pravilnost izvorno se koristila samo za karakterizaciju tvari molekularne strukture. Na primjer, poznate su dvije alotropne modifikacije kisika, čiji atomi čine molekule. Kasnije, istraživači su utvrdili da izmjene mogu biti među kristalima. Prema modernim konceptima, alotropija je jedan od slučajeva polimorfizma. Razlike između oblika uzrokuju mehanizmi formiranja kemijske veze u molekulama i kristalima. Ova se značajka uglavnom očituje u skupinama 13-16 redovitog stola.

Kako drugačija kombinacija atoma utječe na svojstva materije?
Alotropne modifikacije kisika i ozona formiraju atomi elementa s atomskim brojem 8 i istim brojem elektrona. Ali oni se razlikuju po strukturi, što je uzrokovalo značajno odstupanje u svojstvima.
| dokazi | kisik | ozon |
Sastav molekule | 2 atoma kisika | 3 atoma kisika |
| struktura |
| |
| Agregatno stanje i boju | Bezbojni prozirni plin ili blijedo plava tekućina | Plavi plin, plava tekućina, tamno ljubičasta krutina |
| miris | ne | Oštar, podsjeća na grmljavinu, svježe sijeno sijeno |
Talište (° C) | -219 | -193 |
| Točka vrenja (° C) | -183 | -112 |
gustoća (g / l) | 1.4 | 2.1 |
Topivost u vodi | Malo topljivi | Bolje od kisika |
Kemijska aktivnost | U normalnim uvjetima, stabilan | Lako se raspadati formiranjem kisika |
Zaključci iz rezultata usporedbe: alotropne modifikacije kisika se ne razlikuju u kvalitativnom sastavu. Struktura molekule ogleda se u fizikalnim i kemijskim svojstvima tvari.
Je li ista količina kisika i ozona u prirodi?
Tvar čija je formula O2, pojavljuje se u atmosferi, hidrosferi, zemljinoj koru i živim organizmima. Oko 20% atmosfere formiraju molekule diatomskih kisika. U stratosferi na nadmorskoj visini od oko 12-50 km od Zemljine površine nalazi se sloj nazvan "ozonski ekran". Njezin sastav odražava formulu O3. Ozon štiti naš planet apsorbirajući opasne zrake crvenog i ultraljubičastog spektra Sunca. Koncentracija tvari stalno se mijenja, a njezina srednja vrijednost niska - 0,001%. Dakle, O2 i O3 - alotropne modifikacije kisika, koje imaju značajne razlike u njihovoj raspodjeli u prirodi.
Kako mogu dobiti kisik i ozona?
 Molekularni kisik je najvažnija jednostavna supstanca na Zemlji. Obrađuje se u zelenim dijelovima biljaka u svjetlu proces fotosinteze. S električnim ispuštanjem prirodnog ili umjetnog podrijetla, molekula diatomne kisik se raspada. Temperatura na kojoj počinje postupak je oko 2000 ° C. Neki od radikala koji su se pojavili ponovno se sjedinjuju, stvarajući kisik. Neke aktivne čestice reagiraju s molekulama diatomskih kisika. U toj reakciji nastaje ozon, koji također reagira s slobodnim radikalima kisika. U ovom slučaju nastaju diatomske molekule. Reversivnost reakcija dovodi do činjenice da se koncentracija atmosferskog ozona stalno mijenja. U stratosferi, stvaranje sloja koji se sastoji od O3, povezana je s ultraljubičastim zračenjem Sunca. Bez ovog zaštitnog štitnika, opasne zrake mogu doći do površine Zemlje i uništiti sve oblike života.
Molekularni kisik je najvažnija jednostavna supstanca na Zemlji. Obrađuje se u zelenim dijelovima biljaka u svjetlu proces fotosinteze. S električnim ispuštanjem prirodnog ili umjetnog podrijetla, molekula diatomne kisik se raspada. Temperatura na kojoj počinje postupak je oko 2000 ° C. Neki od radikala koji su se pojavili ponovno se sjedinjuju, stvarajući kisik. Neke aktivne čestice reagiraju s molekulama diatomskih kisika. U toj reakciji nastaje ozon, koji također reagira s slobodnim radikalima kisika. U ovom slučaju nastaju diatomske molekule. Reversivnost reakcija dovodi do činjenice da se koncentracija atmosferskog ozona stalno mijenja. U stratosferi, stvaranje sloja koji se sastoji od O3, povezana je s ultraljubičastim zračenjem Sunca. Bez ovog zaštitnog štitnika, opasne zrake mogu doći do površine Zemlje i uništiti sve oblike života.
Alotropne modifikacije kisika i sumpora
Kemijski elementi O (Oxygenium) i S (sumpor) nalaze se u istoj skupini periodičnog stola, karakteriziraju ih formiranje alotropnih oblika. Od molekula s različitim brojem atoma sumpora (2, 4, 6, 8) u normalnim uvjetima, najstabilniji je S8, nalik krunici u obliku. Romični i monoklinski sumpor su konstruirani od takvih 8-atoma molekula.
 Pri temperaturi od 119 ° C, monoklinski žuti oblik tvori smeđu, viskoznu masu, plastičnu modifikaciju. Istraživanje alotropnih modifikacija sumpora i kisika od velike je važnosti u teorijskoj kemiji i praktičnoj aktivnosti.
Pri temperaturi od 119 ° C, monoklinski žuti oblik tvori smeđu, viskoznu masu, plastičnu modifikaciju. Istraživanje alotropnih modifikacija sumpora i kisika od velike je važnosti u teorijskoj kemiji i praktičnoj aktivnosti.

Oksidirajuća svojstva različitih oblika koriste se u industrijskom mjerilu. Ozon se koristi za dezinfekciju zraka i vode. No, pri koncentracijama iznad 0,16 mg / m3, ovaj je plin opasan za ljude i životinje. Molekularni kisik je neophodan za disanje, koristi se u industriji i medicini. Važnu ulogu u gospodarskoj aktivnosti igraju alotropi ugljika (dijamant, grafit), fosfor (bijeli, crveno) i druge kemijske elemente.
 Što se sastoji od vode: od kojih molekule i atomi
Što se sastoji od vode: od kojih molekule i atomi Što je složena tvar? Kako se to događa?
Što je složena tvar? Kako se to događa? Fizička svojstva aldehida
Fizička svojstva aldehida Molarna masa kisika. Koja je molarnu masu kisika?
Molarna masa kisika. Koja je molarnu masu kisika? Molekula: masa molekule. Dimenzije i masa molekula
Molekula: masa molekule. Dimenzije i masa molekula Ozon (kemijski element): svojstva, formula, oznaka
Ozon (kemijski element): svojstva, formula, oznaka Što je kemijska tvar? Svojstva tvari. Kategorije tvari
Što je kemijska tvar? Svojstva tvari. Kategorije tvari Alotropne tvari: dijamant i grafit. Formula grafita i dijamanta.
Alotropne tvari: dijamant i grafit. Formula grafita i dijamanta. Anorganske tvari
Anorganske tvari Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari Kemijska struktura tvari
Kemijska struktura tvari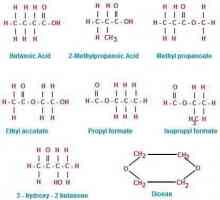 Što su strukturni izomeri
Što su strukturni izomeri Alotropne modifikacije fosfora: svojstva i svojstva
Alotropne modifikacije fosfora: svojstva i svojstva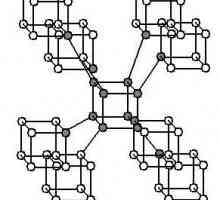 Alotropija je ... Definicija pojma i uzroka
Alotropija je ... Definicija pojma i uzroka Reakcije smanjenja oksidacije
Reakcije smanjenja oksidacije Bijeli fosfor, crvena i crna - svojstva i primjena
Bijeli fosfor, crvena i crna - svojstva i primjena Jednostavne tvari
Jednostavne tvari Alotropne modifikacije
Alotropne modifikacije Struktura materije
Struktura materije Što je vodikova veza? Vrste, utjecaj
Što je vodikova veza? Vrste, utjecaj Ionska kristalna rešetka
Ionska kristalna rešetka

 Što je složena tvar? Kako se to događa?
Što je složena tvar? Kako se to događa? Molarna masa kisika. Koja je molarnu masu kisika?
Molarna masa kisika. Koja je molarnu masu kisika? Molekula: masa molekule. Dimenzije i masa molekula
Molekula: masa molekule. Dimenzije i masa molekula Ozon (kemijski element): svojstva, formula, oznaka
Ozon (kemijski element): svojstva, formula, oznaka Što je kemijska tvar? Svojstva tvari. Kategorije tvari
Što je kemijska tvar? Svojstva tvari. Kategorije tvari Alotropne tvari: dijamant i grafit. Formula grafita i dijamanta.
Alotropne tvari: dijamant i grafit. Formula grafita i dijamanta. Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari Kemijska struktura tvari
Kemijska struktura tvari