Odredite valenciju kemijskih elemenata
Razina znanja o strukturi atoma i molekula u XIX stoljeću nije nam omogućila da objasnim razloge zašto atomi čine određeni broj veza s drugim česticama. Ali ideje znanstvenika nadmašile su svoje vrijeme, a valencija se još uvijek proučava kao jedan od osnovnih principa kemije.
sadržaj
- Iz povijesti koncepta "valencije kemijskih elemenata"
- Razvoj pogleda
- Grafički prikaz valencije i kemijskih veza
- Valencija za vodik i kisik
- Kako odrediti valenciju kemijskih elemenata
- Stalna i varijabilna valencija
- Suvremeni koncepti valencije
- Ovisnost valentnosti na strukturi atoma
- Valencija i stanje oksidacije
Iz povijesti koncepta "valencije kemijskih elemenata"
Izvanredni engleski kemičar iz XIX stoljeća, Edward Frankland uveo je pojam "povezanost" u znanstvenoj uporabi kako bi opisao proces interakcije atoma jedni s drugima. Znanstvenik je primijetio da neki kemijski elementi tvore spojeve s istim brojem drugih atoma. Na primjer, dušik kombinira tri vodikova atoma u molekuli amonijaka.

U svibnju 1852. Frankland je pretpostavio da postoji određeni broj kemijskih veza koje jedan atom može oblikovati s drugim sitnim česticama tvari. Frankland je koristio izraz "vezna sila" kako bi opisao što će se kasnije nazvati valencijom. Britanski kemičar utvrdio je koliko kemijskih veza tvore atome pojedinih elemenata poznati sredinom XIX. Stoljeća. Rad Franklanda bio je važan doprinos modernoj strukturnoj kemiji.

Razvoj pogleda
Njemački kemičar F.A. Kekule je 1857. godine dokazao da je ugljik četverostruka baza. U svom najjednostavnijem spoju - metanu - postoje veze s 4 vodikova atoma. Pojam "bazičnost" koji je znanstvenik koristio za prepoznavanje svojstava elemenata da pripiše strogo definiran broj drugih čestica. U Rusiji, podaci o struktura materije sustavizirao je AM Butlerov (1861). Daljnji razvoj teorije kemijskog povezivanja bio je posljedica teorije periodičkih promjena svojstava elemenata. Njegov autor je još jedan izvanredan Ruski kemičar, D. I. Mendelejev. Dokazao je da je valencija kemijskih elemenata u spojevima i drugim svojstvima zbog pozicije koju zauzimaju u periodičkom sustavu.
 Grafički prikaz valencije i kemijskih veza
Grafički prikaz valencije i kemijskih veza
Mogućnost vizualizacije molekula jedan je od nedvojbenih zasluga teorije valencije. Prvi modeli pojavljuju se u 1860-ima, a od 1864. godine strukturne formule, To su krugovi s kemijskim znakom iznutra. Između simbola atoma crtica označena je s kemijsko lijepljenje, a broj tih linija jednak je vrijednosti valencije. U istom su godinama proizvedeni prvi modeli lopatice i štapića (vidi fotografiju s lijeve strane). Godine 1866. Kekule je predložio stereokemijski crtež ugljikovog atoma u obliku tetraedra koji je uključio u udžbenik "Organska kemija".
Valencija kemijskih elemenata i pojava veza proučavala je G. Lewis, koji je 1923. godine objavio svoja djela otkrića elektrona. Nazvane su tzv. Negativno napunjene sitne čestice, koje su dio školjki atoma. U svojoj knjizi, Lewis je primijenio točke oko četiri strane simbol kemijskog elementa za prikazivanje valentnih elektrona.
Valencija za vodik i kisik
Prije izrade periodičkog sustava valencija kemijskih elemenata u spojevima je uzeta u usporedbi s onim atomima za koje je poznat. Kao standardi izabrani su vodik i kisik. Drugi kemijski element privukao je ili zamijenio određeni broj H i O atoma.

Na taj su način svojstva određena u spojevima s monovalentnim vodikom (valencija drugog elementa označena je rimskim brojem):
- HCl-kloro (I):
- H2O je kisik (II);
- NH3 - dušik (III);
- CH4 - ugljik (IV).
U oksidima K2O, CO, N2O3, SiO2, SO3 određen valenciji metala i nemetala kisik, udvostručenja broja atoma pričvrstiti O. Dobije se sljedeće vrijednosti: K (I), C (II), N (III), Si (IV), S (VI).
Kako odrediti valenciju kemijskih elemenata
Postoje pravilnosti u formiranju kemijske veze koja uključuje uobičajene elektronske parove:
- Tipična vodena valencija je I.
- Uobičajena valencija kisika je II.
- Za nemetalne elemente, niža valencija može se odrediti formulom 8 - brojem skupine u kojoj su u periodnom sustavu. Što je veći, ako je moguće, određuje se brojem skupine.
- Za elemente podgrupa, maksimalna moguća valencija jednaka je broju njihovih grupa u periodičnoj tablici.
Određivanje valencije kemijskih elemenata prema formuli spoja provodi se pomoću sljedećeg algoritma:
- Zapišite iznad kemijske oznake poznatu vrijednost za jedan od elemenata. Na primjer, u Mn2O7 valencija kisika je II.
- Izračunajte ukupnu vrijednost za koju je potrebno umnožiti valenciju za broj atoma istog kemijskog elementa u molekuli: 2 * 7 = 14.
- Odredite valenciju drugog elementa za koji je nepoznat. Podijelite vrijednost dobivena u pododjeljku 2 za broj atoma Mn u molekuli.
- 14: 2 = 7. Valencija mangana u višem oksidu je VII.
Stalna i varijabilna valencija
Vrijednosti za vodik i kisik su različite. Na primjer, sumpor u spoju H2S je dvovalentan i u formuli SO3 - Heksavalentni. Karbonni oblici s ugljičnim monoksidom kisika i CO dioksidom2. U prvom spoju valencija C je II, au drugom, IV. Ista vrijednost u metanu CH4.

Većina elemenata nije konstantna, već varijabilna valencija, na primjer, fosfor, dušik, sumpor. Potraga za glavnim uzrocima ovog fenomena dovela je do pojave teorija kemijskog povezivanja, ideja o valentnoj ljusci elektrona, molekularnih orbita. Postojanje različitih vrijednosti iste imovine objašnjeno je u smislu strukture atoma i molekula.
Suvremeni koncepti valencije
Svi atomi se sastoje od pozitivne jezgre okružene negativnim nabojem elektrona. Vanjska školjka, koju čine, nedovršena je. Završena struktura je najstabilnija, sadrži 8 elektrona (oktet). Pojava kemijske veze zbog zajedničkih elektronskih parova dovodi do energetski povoljnog stanja atoma.
Pravilo za formiranje spojeva je dovršetak ljuske uzimanjem elektrona ili povlačenje nesparenoga - ovisno o tome koji je postupak lakše proći. Ako atom daje negativne čestice za stvaranje kemijske veze, koje nemaju par, onda tvori toliko veza kao što postoje nespareni elektroni. Prema modernim konceptima valencija atoma kemijskih elemenata je sposobnost da formira određeni broj kovalentnih veza. Na primjer, u molekuli sumporovodika H2S sumpor dobiva valenciju II (-), budući da svaki atom sudjeluje u stvaranju dvaju elektronskih parova. Znak ";" označava atrakciju elektronskog para na više elementa elektronskih elemenata. Na manje electronegative za vrijednost valencije, dodajte "+".

S mehanizmom akceptora donatora, u procesu sudjeluju elektronski parovi jednog elementa i orbitalne valne valencije.
Ovisnost valentnosti na strukturi atoma
Razmotriti, na primjer, ugljik i kisik, kako valencija kemijskih elemenata ovisi o strukturi materije. Mendelejevev stol daje ideju o glavnim karakteristikama atoma ugljika:
- kemijski znak - C;
- broj elementa je 6;
- naboj jezgre je +6;
- protoni u jezgri - 6;
- elektrona - 6, uključujući 4 vanjska, od kojih su 2 parova, 2 - nespareni.
Ako ugljikov atom u CO monooksidu tvori dvije veze, tada samo 6 negativnih čestica ulazi u njegovu upotrebu. Da bi stekli oktet, potrebno je da parovi tvore 4 vanjske negativne čestice. Ugljik ima valenciju IV (+) u dioksidu i IV (-) u metanu.
Redni broj kisika je 8, valentna školjka se sastoji od šest elektrona, od kojih dva ne formiraju par i sudjeluju u kemijskom vezivanju i interakciji s drugim atomima. Tipična valentna kisik je II (-).

Valencija i stanje oksidacije
U mnogim slučajevima je prikladnije koristiti termin "oksidacijsko stanje". Ovo je naziv za naboj atoma, koji bi stekao ako su svi vezani elektroni preneseni na element koji ima veću vrijednost elektroniegativnosti (EO). Oksidirajući broj u jednostavnoj supstanci je nula. U oksidacijsko stanje više EO elementa dodaje se znak ";", manji od elektronskog spoja - "+". Na primjer, za metale glavnih podskupina stupnjevi oksidacije i ionski naboji ekvivalentni su broju skupine s znakom "+". U većini slučajeva valencija i stupanj oksidacije atoma u istom spoju su brojčano jednaki. Samo kada je u interakciji s više elektronskih atoma, stupanj oksidacije je pozitivan, s elementima za koje je EO niži, negativan. Koncept "valencije" često se primjenjuje samo na tvari molekularne strukture.
 Što je složena tvar? Kako se to događa?
Što je složena tvar? Kako se to događa? Kakva je valencija sumpora? Moguće valencije sumpora
Kakva je valencija sumpora? Moguće valencije sumpora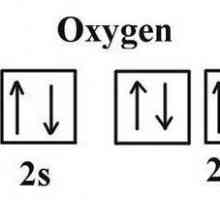 Koja je kisika kisika u spojevima?
Koja je kisika kisika u spojevima? Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari Kako odrediti stupanj oksidacije
Kako odrediti stupanj oksidacije Kako odrediti valenciju
Kako odrediti valenciju Što je atom promjera? Veličina atoma
Što je atom promjera? Veličina atoma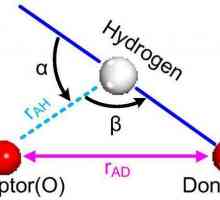 Vodikova veza: primjeri i vrste kemijskih veza
Vodikova veza: primjeri i vrste kemijskih veza Periodni zakon
Periodni zakon Glavne vrste kemijskih veza: zašto i kako se formiraju
Glavne vrste kemijskih veza: zašto i kako se formiraju Kovalentna veza
Kovalentna veza Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva
Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva Jednostavne tvari
Jednostavne tvari Struktura materije
Struktura materije Heterociklički spojevi: nomenklatura i klasifikacija
Heterociklički spojevi: nomenklatura i klasifikacija Što je vodikova veza? Vrste, utjecaj
Što je vodikova veza? Vrste, utjecaj Metalno lijepljenje
Metalno lijepljenje Ion vezivanje
Ion vezivanje Značajke strukture atoma metala
Značajke strukture atoma metala Ukratko o kompleksu: struktura školjaka atoma elektrona
Ukratko o kompleksu: struktura školjaka atoma elektrona Osnove anorganske kemije. Stupanj oksidacije
Osnove anorganske kemije. Stupanj oksidacije
 Kakva je valencija sumpora? Moguće valencije sumpora
Kakva je valencija sumpora? Moguće valencije sumpora Koja je kisika kisika u spojevima?
Koja je kisika kisika u spojevima? Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari Što je atom promjera? Veličina atoma
Što je atom promjera? Veličina atoma Vodikova veza: primjeri i vrste kemijskih veza
Vodikova veza: primjeri i vrste kemijskih veza