Karbid: formula, primjena i svojstva
Mnogo različitih kemijskih spojeva poznato je u svijetu: stotinama milijuna. A svi, poput ljudi, su individualni. Ne možete naći dvije tvari koje imaju iste kemijske i fizičke osobine za različite pripravke.
sadržaj
Jedna od najzanimljivijih anorganskih tvari koja se nalazi na svijetu jest karbidi. U ovom ćemo članku raspravljati o njihovoj strukturi, fizikalnim i kemijskim svojstvima, primjeni i analiziranju detalja njihove proizvodnje. Ali prvo, malo o povijesti otkrića.

priča
Karbidi metala, formule koje ćemo dati dolje, nisu prirodni spojevi. To je zbog činjenice da se njihove molekule sklone raspadanju u interakciji s vodom. Stoga vrijedi razgovarati o prvim pokušajima sintetiziranja karbida.
Od 1849. došlo je do referenci na sintezu silicijevog karbida, ali neki od tih pokušaja ostaju nepriznati. Velika proizvodnja započela je 1893. godine od američkog kemičara Edwarda Achesona na način koji je kasnije dobio ime po njemu.
Povijest sinteze kalcijevog karbida također nije jako različita. Godine 1862. primio je njemačkog kemičara Friedricha Wöhlera, grijanje fuzioniranog cinka i kalcija s ugljenom.
Sada idemo na zanimljive odjeljke: kemijska i fizička svojstva. Uostalom, oni su bit primjene ove klase tvari.

Fizička svojstva
Apsolutno svi karbidi razlikuju se u svojoj tvrdoći. Na primjer, jedan od najvažnijih Mohsova ljestvica je volfram karbid (9 od 10 mogućih bodova). Osim toga, te tvari su vrlo vatrostalne: točka taljenja nekih od njih doseže dvije tisuće stupnjeva.
Većina karbida je kemijski inertna i interakciju s malom količinom tvari. Nisu topljivi u bilo kojem otapalu. Međutim, interakcija s vodom može se smatrati otapanjem, uz uništavanje veza i stvaranje hidroksida metala i ugljikovodika.
Posljednja reakcija i mnoge druge zanimljive kemijske transformacije koje uključuju karbide će se raspravljati u sljedećem odjeljku.

Kemijska svojstva
Gotovo svi karbidi reagiraju s vodom. Neki su jednostavni i bez grijanja (na primjer, kalcijev karbid), i neke (na primjer, silicijev karbid) - kada se vodena para zagrijava do 1800 stupnjeva. Reaktivnost u ovom slučaju ovisi o prirodi veze u spoju, o čemu ćemo govoriti kasnije. U reakciji s vodom, nastaju različiti ugljikovodici. To se događa zato što je vodik koji se nalazi u vodi povezan s ugljikom u karbidu. Da biste shvatili kakav će se ugljikovodik dobiti (ili se može dobiti i ograničavajuće i nezasićeni spoj), može se nastaviti od valencije ugljika sadržane u početnoj tvari. Na primjer, ako imamo kalcijev karbid, formula koja je CaC2, vidimo da ona sadrži ion C22-. Stoga se na njega mogu priključiti dva vodikova iona s nabojem +. Tako dobivamo spoj C2H2 - acetilen. Na isti način, iz spoja kao što je aluminijski karbid, formula od kojeg Al4C3, dobivamo CH4. Zašto ne C3H12, pitate? Uostalom, ion ima naboj od 12-. Činjenica je da maksimalni broj vodikovih atoma određuje formula 2n + 2, pri čemu je n broj ugljikovih atoma. Stoga postoji samo spoj sa formulom C3H8 (propan), te da ion s nabojom od 12 - propada u tri iona s nabojem od 4, koje daju kada se kombiniraju s protonom molekula metana.
Zanimljive su reakcije oksidacije karbida. Mogu se pojaviti i pod utjecajem jakih oksidacijskih smjesa, te u običnom izgaranju u atmosferi kisika. Ako je s kisikom sve prozirno: dobivaju se dva oksida, a onda s drugim oksidansima zanimljiviji. Sve ovisi o prirodi metala koji je dio karbida, kao io prirodi oksidansa. Na primjer, silikonski karbid, čija je formula SiC, nakon interakcije s mješavinom dušičnih i fluorovodična kiselina formira heksafluorosilnu kiselinu oslobađanjem ugljičnog dioksida. I kada provodimo istu reakciju, ali samo sa dušičnom kiselinom, dobivamo silicijev oksid i ugljičnog dioksida. Oksidatori također mogu uključivati halogene i kalkogene. S njima, svaki karbid reagira, reakcijska formula ovisi samo o njegovoj strukturi.
Metalni karbidi, formule koje smo razmotrili, nipošto nisu jedini predstavnici ove klase spojeva. Sada ćemo bliže pogledati svaku industrijski važnu kombinaciju ove klase, a zatim razgovarati o njihovoj primjeni u našem životu.

Što su karbidi?
Ispada da je karbid, formula koja, recimo, CaC2 bitno se razlikuje u strukturi od SiC. A razlika je prvenstveno u prirodi veze između atoma. U prvom slučaju, imamo posla s karbidom soli. Ova klasa spojeva naziva se tako jer se zapravo ponaša kao sol, tj. Sposobna je disocirati u ione. Takva ionska veza je vrlo slaba, što olakšava provođenje reakcija hidrolize i mnoge druge transformacije koje uključuju interakcije između iona.
Drugi vjerojatno važniji tip karbida su kovalentni karbidi: kao što je, na primjer, SiC ili WC. Karakterizira ih visoka gustoća i snaga. Kao i vatrostalna i inertna sredstva za razrjeđivanje.
Također postoje metalni karbidi. Oni se radije mogu smatrati legurama metala s ugljikom. Među njima možemo razlikovati, na primjer, cementit (željezni karbid, formula koja varira, ali u prosjeku je približno jednaka: Fe3C) ili od lijevanog željeza. Oni imaju intermedijer kemijske aktivnosti u njihovom stupnju između ionskih i kovalentnih karbida.
Svaka od tih podvrsta klase kemijskih spojeva o kojima raspravljamo ima svoju praktičnu primjenu. O tome kako i gdje se svaki od njih primjenjuje, razgovarat ćemo u sljedećem odjeljku.

Praktična primjena karbida
Kao što smo rekli, kovalentne karbidi imaju najveći raspon praktičnih primjena. Ovaj abrazivna ili rezanje materijala i kompozitni materijali koji se koriste u raznim područjima (na primjer, kao što je jedan od materijala koji su tijelo oklop), i auto dijelova i elektroničkih instrumenata i grijačima, i nuklearne energije. A to nije potpuni popis programa tih superhard karbida.
Najuža uporaba izrađena je od karbida koji tvore soli. Njihova reakcija s vodom koristi se kao laboratorijska metoda za proizvodnju ugljikovodika. Način na koji se to dogodi već smo rastavili.
Uz kovalentne karbidne metale imaju najširu primjenu u industriji. Kao što smo već rekli, takav metalni tip spojeva o kojima raspravljamo jesu čelici, lijevane željeznice i ostali spojevi metala s impregnacijama ugljika. U pravilu, metal sadržan u takvim tvarima pripada klasi d-metala. Zato je sklon stvaranju ne kovalentnih veza, već kao da prodire u strukturu metala.
Prema našem mišljenju, ima više nego dovoljno praktičnih primjena za gore spomenute spojeve. Pogledajmo sada proces njihova dobivanja.
Proizvodnja karbida
Prve dvije vrste karbida koje smo razmotrili, a to su kovalentne i soli, dobivene najčešće na jedan jednostavan način: reakcijom elementarnog oksida i koksa na visokoj temperaturi. Istovremeno, dio koksa koji se sastoji od ugljika kombinira se s atomom elementa u oksidu i tvori karbid. Drugi dio "uzima" kisik i tvori ugljični monoksid. Ova metoda je vrlo intenzivna jer zahtijeva održavanje visoke temperature (oko 1600-2500 stupnjeva) u reakcijskoj zoni.
Za dobivanje nekih vrsta spojeva koriste se alternativne reakcije. Na primjer, razgradnja spoja, koja na kraju daje karbid. Reakcijska formula ovisi o specifičnom spoju, stoga ga nećemo raspravljati.
Prije nego dovršimo naš članak, raspravljat ćemo o nekim zanimljivim karbidima i razgovarati o njima detaljnije.
Zanimljivi spojevi
Natrijev karbid. Formula za ovaj spoj C2na2. To može biti više kao acetilenid (tj. Produkt supstitucije vodikovih atoma u acetilenu za atome natrija), umjesto karbida. Kemijska formula ne u potpunosti odražava ove suptilnosti, pa ih treba tražiti u strukturi. To je vrlo aktivna tvar i, u svakom kontaktu s vodom, vrlo aktivno djeluje zajedno s njim u obliku acetilena i alkalija.
Magnezijev karbid. Formula: MgC2. Metode za pripremu ovog dovoljno aktivnog spoja su zanimljive. Jedan od njih sugerira sinteriranje magnezijevog fluorida s kalcijevim karbidom pri visokim temperaturama. Kao rezultat toga dobivaju se dva produkta: kalcijev fluorid i karbid koji nam je potreban. Formula za ovu reakciju je vrlo jednostavna i možete, ako želite, pročitati u specijaliziranoj literaturi.
Ako niste sigurni u korisnost materijala u članku, sljedeći je odjeljak za vas.

Kako ovo može biti korisno u životu?
Pa, prvo, poznavanje kemijskih spojeva nikad ne može biti suvišno. Uvijek je bolje biti naoružan znanjima nego ostati bez nje. Drugo, što više znate o postojanju određenih spojeva, to bolje razumijete mehanizam njihove formacije i zakone koji im dopuštaju postojati.
Prije odlaska na kraj, želio bih dati neke preporuke za proučavanje ovog materijala.

Kako proučiti ovo?
Vrlo je jednostavno. To je samo dio kemije. I treba ga proučavati prema udžbenicima kemije. Započnite sa školskim informacijama i idite u dublje, od sveučilišnih udžbenika i referentnih knjiga.
zaključak
Ova tema nije tako jednostavna i dosadna kako se čini na prvi pogled. Kemija može uvijek postati zanimljiva, ako nađete svoj cilj.
 Kalcijev karbid
Kalcijev karbid Što su binarnim vezama?
Što su binarnim vezama? Što je složena tvar? Kako se to događa?
Što je složena tvar? Kako se to događa? Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari
Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari Organski materijal njihovih svojstava i klasifikacije
Organski materijal njihovih svojstava i klasifikacije Acetilen: primjena u medicini, industriji
Acetilen: primjena u medicini, industriji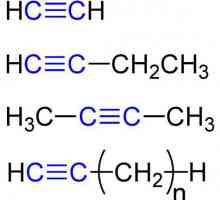 Kemijska svojstva alkina. Struktura, prijem, primjena
Kemijska svojstva alkina. Struktura, prijem, primjena Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane
Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane Gdje pronaći karbid? Koje su mjere opreza potrebne?
Gdje pronaći karbid? Koje su mjere opreza potrebne? Anorganske tvari
Anorganske tvari Koja je priroda oksida
Koja je priroda oksida Hidridi su ... Korištenje hidrida
Hidridi su ... Korištenje hidrida Kako dobiti acetilen iz metana
Kako dobiti acetilen iz metana Što su strukturni izomeri
Što su strukturni izomeri Organski spojevi i njihova klasifikacija
Organski spojevi i njihova klasifikacija Klase anorganskih spojeva
Klase anorganskih spojeva Sinteza proteina
Sinteza proteina Tungsten karbid. Fizička svojstva, toksičnost, primjena
Tungsten karbid. Fizička svojstva, toksičnost, primjena Kemijska svojstva acetilena, osnovne kemijske reakcije, primjena
Kemijska svojstva acetilena, osnovne kemijske reakcije, primjena Anorganske tvari: primjeri i svojstva
Anorganske tvari: primjeri i svojstva Aluminij karbid
Aluminij karbid
 Što su binarnim vezama?
Što su binarnim vezama? Što je složena tvar? Kako se to događa?
Što je složena tvar? Kako se to događa? Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari
Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari Acetilen: primjena u medicini, industriji
Acetilen: primjena u medicini, industriji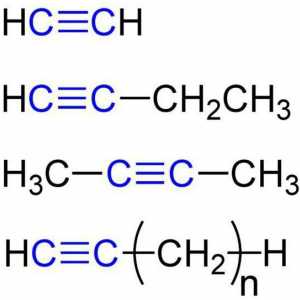 Kemijska svojstva alkina. Struktura, prijem, primjena
Kemijska svojstva alkina. Struktura, prijem, primjena Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane
Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane Gdje pronaći karbid? Koje su mjere opreza potrebne?
Gdje pronaći karbid? Koje su mjere opreza potrebne? Koja je priroda oksida
Koja je priroda oksida