Halogeni: fizikalna svojstva, kemijska svojstva. Upotreba halogena i njihovih spojeva
Halogeni u periodičkom stolu nalaze se lijevo od plemenitih plinova. Ovih pet toksičnih nemetalnih elemenata uključeno je u skupinu 7 periodične tablice. To uključuje fluor, klor, brom, jod i astatin. Iako je astat radioaktivan i ima samo kratkotrajne izotope, ponaša se kao jod, a često se smatraju halogenom. Budući da halogeni elementi imaju sedam valentnih elektrona, trebaju samo jedan dodatni elektron da bi se formirao pun oktet. Ova karakteristika ih čini aktivnijima od ostalih skupina nemetala.
sadržaj
Opće značajke
Halogeni oblikuju diatomske molekule (oblika X2, gdje je X atom halogena) je stabilan oblik postojanja halogena u obliku slobodnih elemenata. Veze ovih diatomske molekule su nepolarne, kovalentne i jednake. Kemijska svojstva halogena omogućuju im da se jednostavno pridruže većini elemenata, pa se nikada ne javljaju u prirodi. Fluor je najaktivniji halogen, a astat je najmanje aktivan.
Svi halogeni tvore soli iz skupine I s sličnim svojstvima. U tim spojevima, halogeni su prisutni u obliku halidnih aniona s nabojem od -1 (na primjer Cl-, br-). Završetak -id označava prisutnost halogenidnih aniona - na primjer Cl- zove se "klorid".
Osim toga, kemijska svojstva halogena omogućuju im da djeluju kao oksidansi - oksidiraju metale. Većina kemijskih reakcija u kojima su uključeni halogeni su redukcija oksidacije u vodenoj otopini. Halogeni oblikuju jednostruke veze s ugljikom ili dušikom u organskih spojeva, gdje je stupanj njihove oksidacije (CO) -1. Kad se atom halogena zamijeni kovalentno vezanim atomom vodika u organskom spoju, halogeni prefiks se može upotrijebiti u općem smislu, ili prefiks fluoro-, kloro-, bromo-, joda za specifične halogene. Halogeni elementi mogu imati križnu vezu s formiranjem diatomske molekule s polarnim kovalentnim jednostrukim vezama.
Klor (Cl2) postao je prvi halogeni otkrio 1774. godine, zatim je otkriven jod (I.2), brom (Br2), fluor (F2) i astat (At, pronađen je posljednji, 1940.). Ime "halogen" dolazi od grčkih korijena hal- ("sol") i -gen ("oblik"). Zajedno, ove riječi znače "oblikovanje soli", ističući činjenicu da halogeni, reagirajući s metalima, tvore soli. Galit je naziv kamene soli, prirodnog minerala koji se sastoji od natrij klorida (NaCl). Konačno, halogeni se koriste u svakodnevnom životu - fluorid se nalazi u zubnoj pasti, klor dezinficira vodu za piće, a jod promovira proizvodnju hormona štitnjače.

Kemijski elementi
Fluor je element s atomskim brojem 9, označen simbolom F. Elementni fluor prvi je put otkriven 1886. godine odvajajući ga od fluorovodične kiseline. U slobodnom stanju, fluor postoji u obliku diatomske molekule (F2) i najčešći je halogen u zemljinoj koru. Fluor je najelegantniji element u periodičnom stolu. Na sobnoj temperaturi je blijedo žuti plin. Fluor također ima relativno mali atomski polumjer. Njegova CO-1, s izuzetkom osnovne diatomske države, u kojoj je stupanj oksidacije nula. Fluor je izuzetno kemijski aktivan i izravno reagira sa svim elementima, osim helija (He), neona (Ne) i argona (Ar). U otopini H2O, fluorovodična kiselina (HF) je slaba kiselina. Iako snažno elektronegativnog fluorom, ne određuju Elektronegativnost kislotnost- HF je slaba kiselina s obzirom na činjenicu da je fluorid iona je bazična (pH> 7). Osim toga, fluor proizvodi vrlo moćne oksidanse. Na primjer, fluor može reagirati s inertnim plinom s ksenonom i tvori jak oksidni ksenon difluorid (XeF2). Fluor ima mnogo koristi.

Klor je element s atomskim brojem 17 i kemijskim simbolom Cl. Pronađeno 1774. godine odvajanjem od klorovodične kiseline. U svom elementarnom stanju, ona tvori diatomsku molekulu, Cl2. Klor ima nekoliko CO: -1, +1, 3, 5 i 7. Na sobnoj temperaturi je svijetlo zeleni plin. Budući da je veza koja se formira između dva atoma klora slaba, Cl molekula2 ima vrlo visoku sposobnost pridruživanja. Klor reagira s metalima radi stvaranja soli, koje se nazivaju kloridi. Klorni ioni su najčešći ioni, oni se nalaze u morskoj vodi. Klor također ima dva izotopa: 35Cl i 37Cl. Natrij klorid je najčešći spoj svih klorida.
Brom je kemijski element s atomskim brojem 35 i simbol br. Prvo je otkriven 1826. godine. U svom osnovnom obliku, brom je diatomska br2. Na sobnoj temperaturi, to je crvenkasto-smeđa tekućina. Njegov CO je -1, + 1, 3, 4 i 5. Brom je aktivniji od joda, ali manje aktivan od klora. Osim toga, brom ima dva izotopa: 79Br i 81Br. Brom se javlja u oblik soli bromida otopljenog u morskoj vodi. Posljednjih godina, svjetska proizvodnja bromida značajno se povećala zbog dostupnosti i dugog vijeka trajanja. Kao i drugi halogeni, brom je oksidacijsko sredstvo i vrlo toksično.

Jod je kemijski element s atomskim brojem 53 i simbolom I. Jod ima oksidacijske stanja: -1, +1, +5 i +7. Ona postoji u obliku diatomske molekule, I2. Na sobnoj temperaturi to je čvrsta supstancija ljubičaste boje. Jod ima jedan stabilni izotop - 127I. Prvo je otkrio 1811. godine uz pomoć algi i sumporne kiseline. Trenutno, jodni ioni mogu se izolirati u morskoj vodi. Unatoč činjenici da jod nije jako topljiv u vodi, njegova topljivost može se povećati upotrebom pojedinačnih jodida. Jod igra važnu ulogu u tijelu, sudjelujući u proizvodnji hormona štitnjače.
Astat je radioaktivni element s atomskim brojem 85 i simbolom At. Njegova moguća oksidacijska stanja su: -1, +1, 3, 5 i 7. Jedini halogen koji nije diatomska molekula. U normalnim uvjetima to je metalna čvrsta crna boja. Astat je vrlo rijedak element, pa je malo poznato. Osim toga, astatin ima vrlo kratak poluživot, ne duže od nekoliko sati. Dobivena 1940. godine kao rezultat sinteze. Smatra se da je astatin sličan jodu. drugačiji metalnih svojstava.
Tablica u nastavku prikazuje strukturu atoma halogena, strukturu vanjskog sloja elektrona.
halogen | Konfiguracija elektrona |
fluor | 1s2 2s2 2p5 |
klor | 3s2 3P5 |
brom | 3d10 4s2 4p5 |
jod | 4d10 5s2 5p5 |
astatin | 4f14 5d10 6s2 6p5 |
Slična struktura vanjskog sloja elektrona uzrokuje da fizikalna i kemijska svojstva halogena budu slična. Istodobno, prilikom usporedbe tih elemenata, uočavaju se i razlike.
Periodna svojstva u halogenoj grupi
Fizička svojstva jednostavnih halogena tvari variraju s povećanjem atomskog broja elementa. Za bolje razumijevanje i veću jasnoću, nudimo Vam nekoliko tablica.
Točke taljenja i vrenja u skupini povećavaju se s veličinom molekule (F
Tablica 1. Halogeni. Fizička svojstva: točka topljenja i vrelište
halogen | Talište (˚C) | Vrelište (˚C) |
fluor | -220 | -188 |
klor | -101 | -35 |
brom | -7.2 | 58.8 |
jod | 114 | 184 |
astatin | 302 | 337 |
- Atomsko polumjer povećava se.
Veličina jezgre se povećava (F < cl < br < ja < At), kako se povećava broj protona i neutrona. Osim toga, s svakim razdobljem dodaju se sve više energije. To dovodi do većeg orbita, a time i povećanja radijusa atoma.
Tablica 2. Halogeni. Fizička svojstva: atomska zraka
halogen | Kovalentni radijus (pm) | Jonski (X-) radijus (pm) |
fluor | 71 | 133 |
klor | 99 | 181 |
brom | 114 | 196 |
jod | 133 | 220 |
astatin | 150 |
- Snaga ionizacije se smanjuje.
Ako vanjski elektronski valenti nisu blizu jezgre, onda im ne treba puno energije da ih uklone. Dakle, energija potrebna za guranje vanjskog elektrona nije toliko visoka u donjem dijelu skupine elemenata, budući da ovdje ima više energije. Osim toga, visoka ionizacijska energija uzrokuje da stanica ima ne-metalne osobine. Jod i prikaz stanja pokazuju metalna svojstva, jer se energija ionizacije smanjuje (br < ja < br < cl < F).
Tablica 3. Halogeni. Fizička svojstva: energija ionizacije
halogen | Energija ionizacije (kJ / mol) |
fluor | 1681 |
klor | 1251 |
brom | 1140 |
jod | 1008 |
astatin | 890 ± 40 |
- Elektronegativnost se smanjuje.
Broj valentnih elektrona u atomu raste s povećanjem razine energije na progresivno nižim razinama. Elektroni su postupno dalje od jezgre, tako da se jezgra i elektroni međusobno ne privlače. Promatra se porast screeninga. Zbog toga se elektronegativnost smanjuje s vremenom povećanja (br < ja < br < cl < F).
Tablica 4. Halogeni. Fizička svojstva: elektronegativnost
halogen | Elektronegativnost |
fluor | 4.0 |
klor | 3.0 |
brom | 2.8 |
jod | 2.5 |
astatin | 2.2 |
- Smanjuje se afinitet za elektron.
Budući da se veličina atoma povećava s vremenom povećanja, afinitet za elektron se u pravilu smanjuje (B < ja < br < F < Cl). Iznimka je fluor, čiji afinitet je manji od klora. To se može objasniti manjom veličinom fluora u usporedbi s klorom.
Tablica 5. Afinitet halogena za elektron
halogen | Afinitet za elektron (kJ / mol) |
fluor | -328,0 |
klor | -349.0 |
brom | -324,6 |
jod | -295.2 |
| astatin | -270,1 |
- Reaktivnost elemenata se smanjuje.
Reaktivnost halogena se smanjuje s vremenom povećanja (At

Anorganska kemija. Vodik + halogeni
Halogen se formira kada halogen reagira s drugim, manje elektronegativnim elementom da bi se formirao binarnom spoju. Vodik reagira s halogenom da nastavi halogenide tipa HX:
- vodik fluorid HF;
- klorovodik HCl;
- hidrobromid HBr;
- hidrogen hidrid HI.
Vodikovi halidi lako se otapaju u vodi formiranjem halogenovodične (fluorovodične, klorovodične, bromovodične, jodovodične) kiseline. Svojstva ovih kiselina su dane u nastavku.
Kiseline se dobivaju slijedećom reakcijom: HX (aq) + H2O (l) → X- (aq) + H3O+ (Aq).
Svi vodikov halogenidi tvore jake kiseline, osim HF.
Kiselost halogenih kiselina povećava se: HF
Hidrofluorna kiselina može dugo vremena izrezati staklo i neke anorganske fluoride.
Čini se nelogičnim da je HF najslabiji halogenovodična kiselina, budući da fluor ima najveću elektronegativnost. Ipak, veza H-F je vrlo jaka, zbog čega je kiselina vrlo slaba. Jaka veza određena je kratkom dužinom veze i visokom energijom disocijacije. Od svih vodikovih halida, HF ima najkraću duljinu veze i najveću energiju vezanja disocijacije.
Halogene okso kiseline
Halogene okso kiseline su kiseline s atomima vodika, kisika i atoma halogena. Njihova kiselost može se odrediti analizom strukture. Halogene okso kiseline su navedene u nastavku:
- Hipoklorna kiselina HOCl.
- HCl kloridne kiseline2.
- HCl kloridne kiseline3.
- HCl kloridne kiseline4.
- Hipobutirna kiselina HOBr.
- Bromo kiselina HBrO3.
- Bromna kiselina HBrO4.
- HOI jodne kiseline.
- Heksanska kiselina HIO3.
- Metionska kiselina HIO4, H5IO6.
U svakoj od ovih kiselina, proton je vezan za kisikov atom, pa je uspoređivanje dužina protonskih veza ovdje beskorisno. Ovdje dominantna uloga je elektronegativnost. Djelovanje kiseline povećava se s brojem atoma kisika vezanim za središnji atom.
Izgled i stanje tvari
Glavna fizikalna svojstva halogena mogu se sažeti u sljedećoj tablici.
Stanje tvari (na sobnoj temperaturi) | halogen | izgled |
firma | jod | purpurna boja |
astatin | crna | |
tekući | brom | riđ |
plinovit | fluor | blijedo žuto-smeđe |
klor | svijetlo zeleno |
Objašnjenje izgleda
Boja halogena rezultat je apsorpcije vidljive svjetlosti molekulama, što uzrokuje uzbuđenje elektrona. Fluor apsorbira ljubičastu svjetlost i stoga izgleda blijedo žuta. Jod, naprotiv, apsorbira žuto svjetlo i izgleda ljubičasta (žuta i ljubičasta - komplementarne boje). Boja halogena postaje tamnija kada se period povećava.

U zatvorenim spremnicima, tekući brom i kruti jod su u ravnoteži s njihovim para, što se može promatrati u obliku obojenog plina.
Iako je boja astatina nepoznata, pretpostavlja se da bi trebalo biti tamnije od joda (tj. Crne boje) u skladu s promatranim uzorkom.
Sada, ako se pitate: "Obilježite fizikalna svojstva halogena", imat ćete nešto za reći.
Stupanj oksidacije halogena u spojevima
Stupanj oksidacije često se koristi umjesto koncepta "valencije halogena". U pravilu, stupanj oksidacije je -1. Ali ako je halogen vezan na kisik ili neki drugi halogen, može se odvijati i druga stanja: CO-kisik-2 ima prioritet. U slučaju da se dva različita atoma halogena spoje zajedno, više elektronegativni atom prevladava i uzima CO-1.
Na primjer, u kloridu joda (IC1), klor ima CO-1 i jod +1. Klor je više elektronegativan nego jod, pa je njegov CO -1.
U bromovoj kiselini (HBrO4) kisik ima CO-8 (-2 x 4 atoma = -8). Vodik ima ukupno stanje oksidacije od +1. Dodavanje ovih vrijednosti daje CO-7. Budući da konačni CO spoja mora biti nula, CO iz broma je +7.
Treća iznimka od pravila je stupanj oksidacije halogena u elementarnom obliku (X2), gdje njegov CO je nula.
halogen | CO u spojevima |
fluor | -1 |
klor | -1, +1, +3, +5, +7 |
brom | -1, +1, +3, +4, +5 |
jod | -1, +1, +5, +7 |
astatin | -1, +1, +3, +5, +7 |
Zašto je CO fluora uvijek -1?
Elektronegativnost se povećava s rastom razdoblja. Stoga, fluor ima najveću elektronegativnost svih elemenata, što je potvrđeno njezinim položajem u periodičnom stolu. Njegova je elektronička konfiguracija 1s2 2s2 2p5. Ako fluor dobije još jedan elektron, ekstremni P-orbiti su potpuno ispunjeni i čine pun oktet. Budući da fluor ima visoku elektronegativnost, može lako uzeti elektron iz susjednog atoma. Fluor u ovom slučaju je izoelektronski na inertni plin (s osam valenata elektrona), sve njezine vanjske orbitale su ispunjene. U ovom stanju, fluorid je mnogo stabilniji.
Priprema i uporaba halogena
U prirodi, halogeni su u stanju aniona, tako da se slobodni halogeni dobivaju oksidacijom elektrolizom ili oksidirajućim sredstvima. Na primjer, klor se proizvodi hidrolizom otopine uobičajene soli. Upotreba halogena i njihovih spojeva je različita.
- fluor. Unatoč činjenici da je fluor vrlo reaktivan, koristi se u mnogim područjima industrije. Na primjer, to je ključna komponenta politetrafluoroetilena (Teflon) i nekih drugih fluoropolimera. Klorofluorougljici su organski kemijskih tvari, koje su prethodno korištene kao rashladne tvari i propelenti u aerosolima. Njihova se uporaba zaustavila zbog njihovog mogućeg utjecaja na okoliš. Zamijenili su ih klorofluorougljikovodici. Fluorid se dodaje pasta za zube (SnF2) i pitke vode (NaF) kako bi se spriječilo propadanje zuba. Ovaj se halogen nalazi u gline za određene vrste keramike (LiF), koristi se u nuklearnoj elektroenergetici (UF6), za pripravu antibiotika fluorokinolona, aluminija (Na3Alf6), za izolaciju visokonaponske opreme (SF6).
- klor također su pronašli razne aplikacije. Koristi se za dezinfekciju pitke vode i bazena. Natrijev hipoklorit (NaClO) je glavna komponenta izbjeljivača. Klorovodična kiselina široko se koristi u industriji i laboratorijima. Klor je prisutan u polivinilkloridu (PVC) i drugim polimerima, koji se koriste za izolaciju ožičenja, cijevi i elektronike. Osim toga, klor je također bio koristan u farmaceutskoj industriji. Lijekovi koji sadrže klor koriste se za liječenje infekcija, alergija i dijabetesa. Neutralni oblik hidroklorida je sastavni dio mnogih lijekova. Klor se također koristi za sterilizaciju bolničke opreme i dezinfekciju. U poljoprivredi, klor je sastavni dio mnogih komercijalnih pesticida: DDT (diklorodifenil-trikloretan) korišten je kao poljoprivredni insekticid, ali njegova je upotreba prekinuta.

- brom, zbog svoje nepotrebe, koristi se za suzbijanje paljenja. Također se nalazi u metil bromidu, pesticidu koji se koristi za pohranu usjeva i inhibiranje bakterija. Ipak, prekomjerna upotreba metilnog bromida prekinuta je zbog utjecaja na ozonski omotač. Brom se koristi za proizvodnju benzina, fotografskih filmova, vatrogasnih aparata, lijekova za liječenje upale pluća i Alzheimerove bolesti.
- jod igra važnu ulogu u pravilnom funkcioniranju štitnjače. Ako tijelo ne dobije dovoljno joda, postoji povećanje štitne žlijezde. Kako bi se spriječio gušavost, ovaj halogen je dodan u sol tablice. Jod se također koristi kao antiseptik. Jod se nalazi u otopinama koje se koriste za čišćenje otvorenih rana, kao iu dezinficijenskim sprejevima. Osim toga, srebrni jodid je važan u fotografiji.
- astatin - radioaktivni i rijetki zemni halogeni, pa se ne koristi ni na jednom drugom mjestu. Ipak, vjeruje se da ovaj element može pomoći jodu u regulaciji hormona štitnjače.
 Molekula vodika: promjer, formula, struktura. Koja je masa molekule vodika?
Molekula vodika: promjer, formula, struktura. Koja je masa molekule vodika?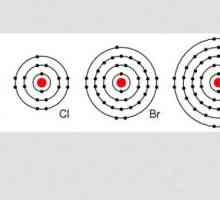 Halogeni su ... Halogeni spojevi
Halogeni su ... Halogeni spojevi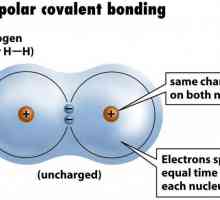 Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna
Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna Halogeni ugljikovodici: proizvodnja, kemijska svojstva, primjena
Halogeni ugljikovodici: proizvodnja, kemijska svojstva, primjena Postupci za proizvodnju alkena: laboratorij i industrijski
Postupci za proizvodnju alkena: laboratorij i industrijski Što su halogeni? Kemijski elementi fluora, klora, joda i astata
Što su halogeni? Kemijski elementi fluora, klora, joda i astata Fluorni kemijski element: valencija, svojstva, svojstva
Fluorni kemijski element: valencija, svojstva, svojstva Elektrofilno dodavanje u organskoj kemiji
Elektrofilno dodavanje u organskoj kemiji Nemetali su ...? Svojstva ne-metala
Nemetali su ...? Svojstva ne-metala Kako odrediti stupanj oksidacije
Kako odrediti stupanj oksidacije Fizička svojstva halogena. Značenje, struktura, uporaba halogena
Fizička svojstva halogena. Značenje, struktura, uporaba halogena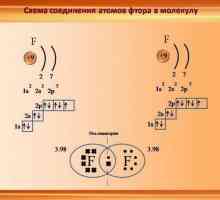 Karakteristike kovalentne veze. Za one tvari je kovalentna veza
Karakteristike kovalentne veze. Za one tvari je kovalentna veza Molarna masa joda i njegove karakteristike
Molarna masa joda i njegove karakteristike Jod: kemijska svojstva, formula, broj u periodnom sustavu
Jod: kemijska svojstva, formula, broj u periodnom sustavu Natrij fenolat: priprema, kemijska svojstva
Natrij fenolat: priprema, kemijska svojstva Što je vodikova veza? Vrste, utjecaj
Što je vodikova veza? Vrste, utjecaj Metalno lijepljenje
Metalno lijepljenje Ion vezivanje
Ion vezivanje Što su halogeni? Kemijska svojstva, svojstva, svojstva proizvodnje
Što su halogeni? Kemijska svojstva, svojstva, svojstva proizvodnje Vanjske razine energije: strukturne značajke i njihova uloga u interakcijama između atoma
Vanjske razine energije: strukturne značajke i njihova uloga u interakcijama između atoma Što je ionska veza? Primjeri tvari s njom i njena svojstva
Što je ionska veza? Primjeri tvari s njom i njena svojstva
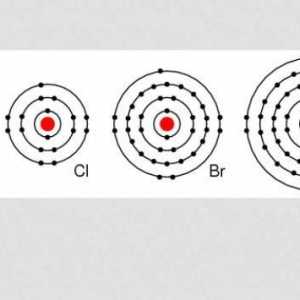 Halogeni su ... Halogeni spojevi
Halogeni su ... Halogeni spojevi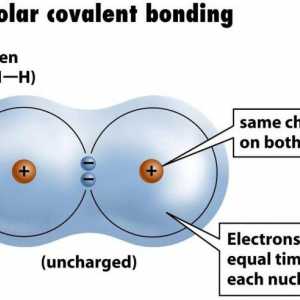 Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna
Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna Halogeni ugljikovodici: proizvodnja, kemijska svojstva, primjena
Halogeni ugljikovodici: proizvodnja, kemijska svojstva, primjena Postupci za proizvodnju alkena: laboratorij i industrijski
Postupci za proizvodnju alkena: laboratorij i industrijski Što su halogeni? Kemijski elementi fluora, klora, joda i astata
Što su halogeni? Kemijski elementi fluora, klora, joda i astata Fluorni kemijski element: valencija, svojstva, svojstva
Fluorni kemijski element: valencija, svojstva, svojstva Elektrofilno dodavanje u organskoj kemiji
Elektrofilno dodavanje u organskoj kemiji Nemetali su ...? Svojstva ne-metala
Nemetali su ...? Svojstva ne-metala Fizička svojstva halogena. Značenje, struktura, uporaba halogena
Fizička svojstva halogena. Značenje, struktura, uporaba halogena