Halogeni ugljikovodici: proizvodnja, kemijska svojstva, primjena
Ugljikovodici su vrlo velika klasa spojeva povezanih s organskim spojevima. Uključuju nekoliko osnovnih skupina tvari, među kojima gotovo svatko pronalazi široku primjenu u industriji, životu, prirodi. Od posebne važnosti su halogenirani ugljikovodici, koji će biti raspravljeni u članku. Oni nisu samo visoke industrijske važnosti, već i važna sirovina za razne kemijske sinteze, proizvodnju lijekova i drugih važnih spojeva. Posebnu pozornost posvetit ćemo strukturi njihovih molekula, svojstava i drugih značajki.
sadržaj

Halogeni ugljikovodici: opća karakteristika
Sa stajališta kemijske znanosti, ova klasa spojeva uključuje sve one ugljikovodike u kojima je jedan ili više vodikovih atoma zamijenjeno s jednim ili više halogena. Ovo je vrlo opsežna kategorija tvari, budući da su od velikog industrijskog značaja. Dugo su ljudi naučili sintetizirati gotovo sve halogenirane ugljikovodike čija je upotreba nužna u medicini, kemijskoj industriji, prehrambenoj industriji i svakodnevnom životu.
Glavna metoda dobivanja tih spojeva je sintetski put u laboratoriju i industriji, budući da praktički nitko od njih ne dolazi u prirodi. Zbog prisutnosti halogena, oni imaju visoku reaktivnost. To u velikoj mjeri određuje područje njihova primjene u kemijskoj sintezi kao međuproizvoda.
Budući da predstavnici halogeniranih ugljikovodika imaju puno, uobičajeno ih je klasificirati prema različitim karakteristikama. Temelj je struktura lanca i mnoštvo veze, kao i razlika u atomima halogena i položaj njihovog položaja.
Halogeni ugljikovodici: razvrstavanje
Prva opcija temelji se na općeprihvaćenim načelima koja se primjenjuju na sve organski spojevi. Klasifikacija se temelji na razlici u vrsti ugljikovog lanca, njegovoj cikličnosti. Prema ovoj značajci, postoje:
- ograničavanje halogeniranih ugljikovodika;
- nezasićen;
- aromatski;
- alifatski;
- aciklički.
Sljedeća podjela temelji se na obliku atoma halogena i njegovog kvantitativnog sadržaja u molekuli. Dakle, dodijelite:
- mono derivata;
- diproizvodnye;
- tri-;
- tetra;
- penta derivata i tako dalje.
Ako govorimo o obliku halogena, tada se naziv podgrupe sastoji od dvije riječi. Na primjer, monoklorni derivat, trijodo derivat, tetrabromo-haloalken i tako dalje.
Postoji još jedna mogućnost razvrstavanja prema kojoj su odijeljeni halogenirani derivati krajnjih ugljikovodika. Ovo je broj ugljikovog atoma na koji je vezan halogen. Dakle, dodijelite:
- primarni derivati;
- sekundarni;
- tercijarni i tako dalje.
Svaki specifični predstavnik može se rangirati po svim znakovima i odrediti ukupno mjesto u sustavu organskih spojeva. Tako, na primjer, spoj sa smjesom CH3 - CH2-CH = CH-CCL3 može se klasificirati kako slijedi. Ovo je nezasićeni alifatski triklor derivat pentena.

Struktura molekule
Prisutnost halogenih atoma ne može utjecati ni na fizikalna i kemijska svojstva, niti na opće obrise strukture molekule. Opća formula za ovu klasu spojeva je R-Hal, gdje je R slobodni ugljikovodični radikal bilo koje strukture i Hal je atom halogena, jedan ili više. Veza između ugljika i halogena je visoko polarizirana, tako da je molekula u cjelini sklona dvama učincima:
- negativni induktivni;
- mesomerni pozitivan.
U ovom slučaju, prvi od njih se izražava mnogo snažnije, stoga Hal atom uvijek pokazuje svojstva elektrona koji odstranjuje supstituent.
Inače, sve značajke strukture molekule ne razlikuju se od onih običnih ugljikovodika. Svojstva se objašnjavaju strukturom lanca i njegovim granatim, brojem ugljikovih atoma, snagom aromatičnih svojstava.
Nomenklatura halogeniranih ugljikovodika zaslužuje posebnu pozornost. Koliko točno trebate nazvati te veze? Da biste to učinili, morate slijediti nekoliko pravila.
- Brojčano označavanje lanca počinje na rubu kojem je atom halogena bliži. Ako postoji bilo kakva višestruka veza, broj počinje točno s njom, a ne sa supstituentom koji povlači elektron.
- Nazivi Hal navedeni su u prefiksu, a broj ugljikovog atoma iz kojeg odlazi također treba navesti.
- Posljednji korak daje naziv glavnog lanca atoma (ili prstenova).
Primjer sličnog naziva: CH2= CH-CHCL2 - 3-dikloropropen-1.
Ime se može dati i na racionalnoj nomenklaturi. U tom se slučaju izražava naziv radikala, a zatim halogen s sufiksom -id. Primjer: S.3-CH2-CH2Br je propil bromid.
Kao i druge klase organskih spojeva, halogenirani ugljikovodici imaju posebnu strukturu. To omogućava mnogim predstavnicima da odredi povijesno formirana imena. Na primjer, CF fluorokarbon3CBrClH. Prisutnost tri halogena u sastavu molekule daje tu tvar s posebnim svojstvima. Koristi se u medicini, tako da se često koristi povijesno oblikovanim imenom.

Metode sinteze
Metode za proizvodnju halogeniranih ugljikovodika su vrlo različite. Postoje pet glavnih metoda sintetiziranja ovih spojeva u laboratoriju i industriji.
- Halogeniranje normalnih ugljikovodika normalne strukture. Opća reakcijska shema: R-H + Hal2 → R-Hal + HHal. Značajke procesa su kako slijedi: s klorom i bromom, ultraljubičasto zračenje je potrebno, s jodom reakcija je praktički nemoguća ili vrlo spora. Uz fluor, interakcija je previše aktivna, tako da ne možete koristiti ovaj halogen u čistom obliku. Dodatno, kada se halogeniraju aromatski derivati, potrebno je upotrijebiti posebne katalizatore Lewisove kiseline. Na primjer, željezo ili aluminij klorid.
- Proizvodnja halogeniranih ugljikovodika provodi se i hidrolizom. Međutim, za to, početni spoj mora nužno biti nezasićen ugljikovodik. Primjer: R = R-R + HHal → R-R-RHal. Najčešće, ovaj elektrofilni dodatak koristi se za proizvodnju kloroetilena ili vinil klorida, budući da je taj spoj važan sirovina za industrijske sinteze.
- Učinak hidrohalogena na alkohole. Opći oblik reakcije: R-OH + HHal → R-Hal + H2O. Posebna značajka je obvezna prisutnost katalizatora. Primjeri procesnih ubrzivača koji se mogu koristiti su: fosfor, sumpor, cink ili željezni kloridi, sumporna kiselina, otopina cinkov klorid u klorovodičnoj kiselini - Lucasin reagens.
- Decarboksilacija kiselinskih soli s oksidirajućim sredstvom. Drugi naziv metode je reakcija Borodin-Hunsdikker. Bit leži u razdvajanju molekule ugljičnog dioksida iz srebrnih derivata karboksilne kiseline kada je izložen oksidirajućem sredstvu - halogen. Kao rezultat toga nastaju halogenirani ugljikovodici. Reakcije u općem obliku izgledaju ovako: R-COOAg + Hal → R-Hal + CO2 + AgHal.
- Sinteza haloformi. Drugim riječima, ovo je proizvodnja trihalogeniranih derivata metana. Najjednostavniji način za njihovu proizvodnju je primjena acetala u otopinu alkalne halogene. Kao rezultat toga nastaju molekule koje tvore halogene. Halogeni aromatski ugljikovodici se sintetiziraju na isti način u industriji.
Posebna pozornost treba posvetiti sintezi nezasićenih predstavnika predmetne klase. Glavna metoda je učinak na alkine soli žive i bakra u prisutnosti halogena, što dovodi do stvaranja proizvoda s dvostrukom vezom u lancu.
Halogeni derivati aromatskih ugljikovodika dobiveni su reakcijama halogeniranja arena ili alkilarena u bočnom lancu. To su važni industrijski proizvodi, jer se koriste kao insekticidi u poljoprivredi.

Fizička svojstva
Fizička svojstva halogenirani ugljikovodici izravno ovise o strukturi molekule. Na točki vrenja i točke topljenja, agregatno stanje utječe broj ugljikovih atoma u lancu i moguće grane sa strane. Što više njih, to su veći brojevi. Općenito, fizički parametri mogu se karakterizirati u nekoliko točaka.
- Agregatno stanje: prvi niži predstavnici su plinovi, nakon C12 - tekućine, iznad krutih tvari.
- Imaju oštar, neugodan, specifičan miris, gotovo svi zastupnici.
- Vrlo slabo topljivi u vodi, ali sami - izvrsna otapala. U organskim spojevima se jako otapaju.
- Kipuće i točke topljenja povećavaju se s brojem ugljikovih atoma u glavnom lancu.
- Svi spojevi osim derivata fluorida su teži od vode.
- Što više grana u glavnom lancu, to je niža vrelište tvari.
Teško je identificirati mnogo sličnih sličnosti, jer predstavnici uvelike variraju u sastavu i strukturi. Stoga je bolje dati vrijednosti za svaki pojedini spoj iz zadanog niza ugljikovodika.
Kemijska svojstva
Jedan od najvažnijih parametara, koji se nužno uzima u obzir u kemijskoj industriji i reakcijama sinteze, su kemijska svojstva halogeniranih ugljikovodika. Nisu isti za sve predstavnike, jer postoji niz razloga za razliku.
- Struktura lanca ugljika. Najjednostavnije reakcije supstitucije (nukleofilne vrste) javljaju se u sekundarnim i tercijarnim haloalkilima.
- Oblik atoma halogena je također važan. Veza između ugljika i Hal je snažno polarizirana, što omogućuje jednostavnu prekid s oslobađanjem slobodnih radikala. Međutim, najlakša je veza upravo između joda i ugljika, što je objašnjeno prirodnom promjenom (smanjenjem) energije vezanja u seriji: F-Cl-Br-I.
- Prisutnost aromatskog radikala ili višestrukih veza.
- Struktura i grananje samog radikala.
Općenito, halogenoalkili se najbolje koriste za specifično reagiranje na nukleofilnu supstituciju. Uostalom, djelomično pozitivno punjenje koncentrirano je na atom ugljika nakon što je prekinuo vezu s halogenom. To dopušta radikalnoj cjelini da postane akceptor elektronskih negativnih čestica. Na primjer:
- OH-;
- SO42-;
- NE2-;
- CN- i drugima.
To objašnjava činjenicu da se halogenirani ugljikovodici mogu pretvoriti u gotovo bilo koju klasu organskih spojeva, samo je potrebno odabrati odgovarajući reagens koji će osigurati željenu funkcionalnu skupinu.
Općenito, može se reći da su kemijska svojstva halogeniranih ugljikovodika sposobnost ući u sljedeće interakcije.
- S nukleofilnim česticama svih vrsta - supstitucijske reakcije. Kao rezultat toga, možete dobiti: alkohole, jednostavne i esteri nitro spojeva, amina, nitrila, karboksilnih kiselina.
- Eliminacije ili reakcije dehidrohalogeniranja. Kao rezultat djelovanja otopine alkalnog alkohola, molekula vodikovog halida se cijepa. Tako nastaje alken, niskopropusni nusproizvodi - sol i voda. Primjer reakcije: CH3-CH2-CH2-CH2Br + NaOH (Alkohol) → CH3-CH2-CH = CH2 + NaBr + H2O. Ovi postupci su jedna od glavnih metoda za sintezu važnih alkena. Proces uvijek prati visoke temperature.
- Priprava alkana normalne strukture metodom sinteze Würza. Bit reakcije sastoji se u izlaganju halogeniranom ugljikovodiku (dvije molekule) s metalnim natrijom. Kao snažno elektropositivni ion, natrij prihvaća atome halogena iz spoja. Kao rezultat toga, oslobođeni ugljikovodični radikali su zajedno zatvoreni vezom, tvoreći alkan nove strukture. Primjer: CH3-CH2Cl + CH3-CH2Cl + 2Na → CH3-CH2-CH2-CH3 + 2NaCl.
- Sinteza homologa aromatskih ugljikovodika metodom Friedel-Crafts. Bit procesa je u djelovanju benzena s haloalkilom u prisutnosti aluminij klorida. Kao rezultat reakcije supstitucije nastaje tvorba toluena i klorovodika. U ovom slučaju, prisutnost katalizatora je neophodna. Osim samog benzena, također je moguće oksidirati homologe na taj način.
- Priprema tekućine Greniard. Ovaj reagens je halogenirani ugljikovodik s magnezijevim ionom u pripravku. U početku je metalni magnezij u eteru izložen haloalkilnom derivatu. Rezultat je kompleks spoj opće formule RMgHal, iz Grenyara reagensa.
- Reakcija redukcije na alkan (alken, aren). Provode se pod utjecajem vodika. Kao rezultat toga nastaje ugljikovodik i nusprodukt, vodikov halogenid. Primjer u općem obliku: R-Hal + H2 → R-H + HHal.
To su glavne interakcije u koje se lako mogu ući halogeni derivati ugljikovodika različitih struktura. Naravno, postoje specifične reakcije koje treba razmotriti za svaki pojedini predstavnik.

Izomerizam molekula
Izomerizam halogeniranih ugljikovodika je vrlo prirodan. Poznato je da što više ugljikovih atoma u lancu, to je veći broj izomernih oblika. Osim toga, nezasićeni predstavnici imaju višestruke veze, što također uzrokuje pojavu izomera.
Možemo razlikovati dvije glavne vrste ovog fenomena za ovu klasu spojeva.
- Izomerizam ugljikovog skeleta radikala i okosnice. To također uključuje položaj višestruke veze, ako postoji u molekuli. Kao kod jednostavnih ugljikovodika, počevši od trećeg predstavnika, moguće je zapisati formule spojeva koji imaju identične molekularne ali različite izraze strukturnih formula. Štoviše, za halogenirane ugljikovodike broj izomernih oblika je red veličine veći nego kod odgovarajućih alkana (alkeni, alkini, areni, itd.).
- Položaj halogena u molekuli. Njegov broj sjedala u naslovu, čak i ako je promjena jedina, svojstva tih izomera će biti sasvim drugačiji.
Nije riječ prostornog izomerizma, budući da atomi halogena čine to nemogućim. Kao i svi ostali organski spojevi, halogenoalkilni izomeri razlikuju se ne samo u strukturi već i po fizičkim i kemijskim svojstvima.

Derivati nezasićenih ugljikovodika
Naravno, postoji mnogo takvih veza. Međutim, zainteresirani su za halogenizirane derivate nezasićenih ugljikovodika. Također se mogu podijeliti u tri glavne skupine.
- Vinil - kada je atom Hal smješten izravno na ugljikovom atomu višestruke veze. Molekula Primjer: CH2= CCL2.
- S izoliranim položajem. Atomi halogena i višestruka veza nalaze se u suprotnim dijelovima molekule. Primjer: S.2= CH-CH2-CH2-Cl.
- Derivati alil - atom halogena dvostruka veza nalazi preko jednog ugljikovog atoma, koja je pohranjena u alfa položaju. Primjer: S.2= CH-CH2-CL.
Od posebne važnosti je spoj kao što je vinil klorid CH2= CHCL. To je sposobno polimerizacijske reakcije s formiranjem važnih proizvoda, kao što su izolacijski materijali, vodonepropusne tkanine i tako dalje.
Drugi predstavnik nezasićenih halogenih derivata je kloropren. Njegova formula je CH2 = CCL-CH = CH2. Ovaj spoj je polazni materijal za sintezu vrijednih vrsta gume, koje se razlikuju po otpornost na požar, dugi vijek trajanja, slabu propusnost za plinove.
Tetrafluoroetilen (ili Teflon) je polimer koji ima kvalitativne tehničke parametre. Koristi se za proizvodnju vrijedne pokrivenosti tehničkih dijelova, posuđa, različitih aparata. Formula - CF2= CF2.
Aromatski ugljikovodici i njihovi derivati
Aromatski su oni spojevi, koji uključuju benzenski prsten. Među njima postoji i čitava skupina halogenih derivata. U strukturi možemo razlikovati dvije glavne vrste njih.
- Ako Hal atom vezan direktno na jezgru, tj aromatskom prstenu, onda je spoj naziva haloarenes.
- Atomi halogena nisu vezani za prsten, već na bočni lanac atoma, to jest radikal koji se proteže u bočnu granu. Takvi spojevi se nazivaju arilalkil halidi.
Među razmatranim sastojcima može se nazvati nekoliko predstavnika s najvećom praktičnom važnošću.
- Heksaklorobenzen - S6cl6. Od početka 20. stoljeća, koristi se kao snažan fungicid, kao i insekticid. Ima dobar učinak dezinfekcije, pa je upotrijebljen za uklanjanje sjemenja prije žetve. Ima neugodan miris, tekućina je vrlo oštra, prozirna, može prouzročiti suzenje.
- Benzil C benzil bromid6H5CH2Br. Koristi se kao važan reagens u sintezi organometalnih spojeva.
- Klorobenzen C6H5CL. Tekuća bezbojna tvar s određenim mirisom. Koristi se u proizvodnji boja, pesticida. To je jedno od najboljih organskih otapala.

Koristite u industriji
Halogeni ugljikovodici su vrlo široko korišteni u industriji i kemijskoj sintezi. Već smo govorili o nezasićenim i aromatskim predstavnicima. Sada ćemo općenito označiti područja korištenja svih spojeva ove serije.
- U izgradnji.
- Kao otapala.
- U proizvodnji tekstila, gume, gume, bojila, polimernih materijala.
- Za sintezu mnogih organskih spojeva.
- Derivati fluora (freoni) su rashladne tvari u rashladnim postrojenjima.
- Koriste se kao pesticidi, insekticidi, fungicidi, ulja, ulja za sušenje, smole, maziva.
- Idite na proizvodnju izolacijskih materijala, itd.
 Prvi predstavnik alkena je etilen. Fizička svojstva, proizvodnja, primjena etilena
Prvi predstavnik alkena je etilen. Fizička svojstva, proizvodnja, primjena etilena Razvrstavanje organskih tvari - osnova za proučavanje organske kemije
Razvrstavanje organskih tvari - osnova za proučavanje organske kemije Kemijska svojstva alkina. Struktura, prijem, primjena
Kemijska svojstva alkina. Struktura, prijem, primjena Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane
Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane Aromatski ugljikovodici: glavni predstavnici i njihova primjena u nacionalnom gospodarstvu.
Aromatski ugljikovodici: glavni predstavnici i njihova primjena u nacionalnom gospodarstvu. Alkadieni su tipični predstavnici nezasićenih ugljikovodika
Alkadieni su tipični predstavnici nezasićenih ugljikovodika Što su aromatski ugljikovodici: formula, svojstva
Što su aromatski ugljikovodici: formula, svojstva Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije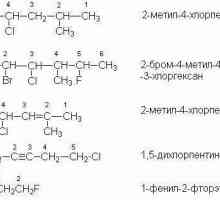 Što je sustavna nomenklatura
Što je sustavna nomenklatura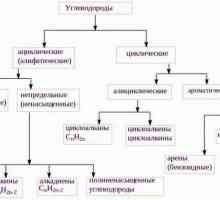 Što su alifatski ugljikovodici?
Što su alifatski ugljikovodici? Zasićeni ugljikovodici: svojstva, formule, primjeri
Zasićeni ugljikovodici: svojstva, formule, primjeri Organski spojevi i njihova klasifikacija
Organski spojevi i njihova klasifikacija Kemijska svojstva alkana
Kemijska svojstva alkana Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva
Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva Serije homologije
Serije homologije Nezasićeni ugljikovodici: alkeni, kemijska svojstva i primjena
Nezasićeni ugljikovodici: alkeni, kemijska svojstva i primjena Alkanes: kemijska svojstva
Alkanes: kemijska svojstva Kemijska svojstva alkena (olefina)
Kemijska svojstva alkena (olefina) Izomeri heptana: opća karakteristika i primjena
Izomeri heptana: opća karakteristika i primjena Kemijska svojstva acetilena, osnovne kemijske reakcije, primjena
Kemijska svojstva acetilena, osnovne kemijske reakcije, primjena Proizvodnja alkana i njihovih svojstava
Proizvodnja alkana i njihovih svojstava
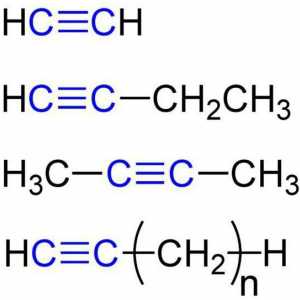 Kemijska svojstva alkina. Struktura, prijem, primjena
Kemijska svojstva alkina. Struktura, prijem, primjena Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane
Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane Alkadieni su tipični predstavnici nezasićenih ugljikovodika
Alkadieni su tipični predstavnici nezasićenih ugljikovodika Što su aromatski ugljikovodici: formula, svojstva
Što su aromatski ugljikovodici: formula, svojstva Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije Što je sustavna nomenklatura
Što je sustavna nomenklatura Što su alifatski ugljikovodici?
Što su alifatski ugljikovodici? Zasićeni ugljikovodici: svojstva, formule, primjeri
Zasićeni ugljikovodici: svojstva, formule, primjeri