Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna
Daleko od zadnje uloge na kemijskoj razini organizacije svijeta igra se način povezivanja strukturnih čestica, veze između sebe. Preveliki broj jednostavnih tvari, odnosno ne-metala, ima kovalentni nepolarni tip veze, osim inertnih plinova.
sadržaj
Sve složene tvari (osim nekih organskih) imaju kovalentne polarne kemijske veze. Vrste i primjeri ovih spojeva bit će diskutirani niže. U međuvremenu je potrebno saznati koja atomska karakteristika utječe na polarizaciju veze.

Elektronegativnost
Atomi, odnosno njihovi jezgri (koji, kao što znamo, pozitivno nabijeni) imaju sposobnost privlačenja i zadržavanja gustoće elektrona, naročito u formiranju kemijske veze. Ova je imovina nazvana electronegativity. U periodičnom stolu njegova se veličina povećava u razdobljima i glavnim podskupinama elemenata. Vrijednost elektronegativnosti nije uvijek konstantna i može se promijeniti, na primjer, s promjenom tipa hibridizacije u koju se atomske orbite.
Kemijske veze, tipovi i primjeri koji će biti navedeni niže, točnije, lokalizacija ili djelomično pomicanje ovih veza na jedno od veznih sredstava, objašnjava se upravo elektroegativnim svojstvima elementa. Raspršivanje se događa atomu u kojem je jači.
Kovalentna nepolarna veza
„Formula” nepolarne kovalentne veze jednostavan - dva atoma iste prirode su kombinirani zajedno u paru elektrona njihov valentni školjke. Takav par naziva podijeljena jer pripada objema stranama jednako obvezujuća. To je zbog gustoće elektrona u socijalizacije para elektrona atoma kretati u stabilnom stanju od potpune njihove vanjske razine elektron, a „oktet” (ili „dvostruki” u slučaju vodik, jednostavne supstance H2, ima jedan s-orbital, koji zahtijeva da dva elektrona završi) je stanje vanjske razine na koju svi atomi nastoje, budući da njegovo punjenje odgovara stanju s minimalnom energijom.
Primjer nepolarne kovalentnom vezom u anorganske tvari i, čudno kako je svibanj zvuk, ali u organskoj kemiji, previše. Ovaj tip veze je zajedničko svim jednostavne tvari - osim plemenitih plinova nemetala, kao razina valence inertnog atoma plina, a već je završio oktet elektrona, a time i sa sličnim obvezujući sebi nema smisla za njega, a još manje energetski povoljna. U ne-polarnosti organske tvari nalaze u nekom određenom strukturi molekule i uvjetovana.
Kovalentna polarna veza
Primjer nepolarni kovalentna veza ograničeni na nekoliko molekula jednostavne supstance, a spojevi dipola u kojem je gustoća elektrona djelomično je pomaknuta prema više elektronegativnog elementa, - velika većina. Bilo koju kombinaciju atoma različita elektronegativnosti vrijednosti daje polarno vezu. Posebno zbog organske tvari - polarnom kovalentnom vezom. Ponekad ionski anorganski oksidi su također polarne i soli kiselina i ionskih veza prevladava tip.
Kao ekstremni slučaj polarnog vezanja ponekad se razmatra ionski tip spojeva. Ako je elektronegativnost jednog od elemenata znatno veća od one druge, elektronski par u potpunosti se prebacuje od središta komunikacije do njega. Tako se ioni dijeli. Onaj tko uzima elektronski par, pretvori se u anion i dobije negativni naboj, a gubitnik elektrona - pretvara se u kation i postaje pozitivan.
Primjeri anorganskih tvari s kovalentnim nepolarnim vezivnim tipom
Tvari s nepolarnim kovalentnom vezom - je, na primjer, svi su binarni molekule plina: vodika (H - H), kisik (= O), dušik (u molekuli 2 atoma povezan trostruku vezu (N equiv- N)) - tekuće i krute tvari: klora (Cl - Cl), fluor (F - F), brom (Br - Br), jod (I - I). Također kompleks tvari koje se sastoje od atoma različitih elemenata, a s stvarne vrijednosti istog elektronegativnosti, na primjer, fosfor hidrid - PH3.
Organska i nepolarna veza
Izuzetno je jasno da sve Organska tvar kompleks. Postavlja se pitanje, kako može nepolarna veza u složenoj supstanci? Odgovor je prilično jednostavan, ako mislite malo logično. Ako se vrijednosti elektroniegativnosti vezanih elemenata malo razlikuju i ne stvaraju moment dipola u vezi, takva veza može se smatrati nepolarnom. Upravo je ta situacija s ugljikom i vodikom: sve S-ionske veze u organskim tvarima smatraju se nepolarnim.
Primjer nepolarne kovalentne veze je molekula metana, najjednostavnija organski spoj. Sastoji se od jednog ugljikovog atoma koji je, prema svojoj valenciji, vezan jednostrukim vezama na četiri atoma vodika. Zapravo, molekula nije dipol, jer u njemu nema lokalizacije naboja, na neki način i zbog tetraedarske strukture. Gustoća elektrona je ravnomjerno raspoređena.
Primjer nepolarne kovalentne veze također se nalazi u složenijim organskim spojevima. Ostvaruje se zbog mezomernih učinaka, tj. Sekvencijalnog povlačenja gustoće elektrona, koja se brzo istječe duž lanca ugljika. Dakle, u molekuli heksakloroetana, C-C veza je nepolarna zbog jednolikog povlačenja gustoće elektrona sa šest atoma klora.
Ostale vrste veza
Uz kovalentnu vezu, koja se, usput, također može realizirati mehanizmom akceptora donatora, odvijaju se ionske, metalne i vodikove veze. Kratke karakteristike pretposljednje dvije prezentirane su gore.
Vodikova veza je intermolekularna elektrostatska interakcija koja se opaža ako molekula ima atom vodika i bilo koji drugi koji ima nepovezane elektronske parove. Ova vrsta vezivanja mnogo je slabija od ostalih, ali zbog činjenice da se mnogo može formirati u supstanci ovih veza, čini značajan doprinos svojstvima spoja.
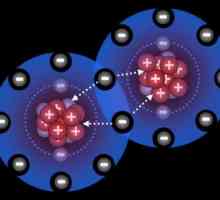 Donator-akceptorski mehanizam: primjeri. Što je mehanizam akceptora donatora?
Donator-akceptorski mehanizam: primjeri. Što je mehanizam akceptora donatora? Donja-akceptorska veza: primjeri tvari
Donja-akceptorska veza: primjeri tvari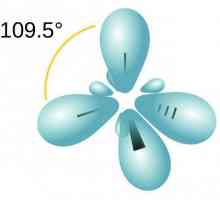 Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije Kako odrediti stupanj oksidacije
Kako odrediti stupanj oksidacije Vrste kristalnih rešetki različitih tvari
Vrste kristalnih rešetki različitih tvari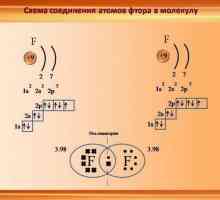 Karakteristike kovalentne veze. Za one tvari je kovalentna veza
Karakteristike kovalentne veze. Za one tvari je kovalentna veza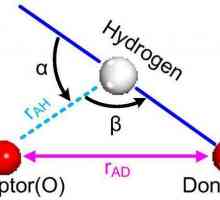 Vodikova veza: primjeri i vrste kemijskih veza
Vodikova veza: primjeri i vrste kemijskih veza Glavne vrste kemijskih veza: zašto i kako se formiraju
Glavne vrste kemijskih veza: zašto i kako se formiraju Kovalentna veza
Kovalentna veza Atomska kristalna rešetka
Atomska kristalna rešetka Što je vodikova veza? Vrste, utjecaj
Što je vodikova veza? Vrste, utjecaj Ionska kristalna rešetka
Ionska kristalna rešetka Što je kovalentna polarna veza
Što je kovalentna polarna veza Metalno lijepljenje
Metalno lijepljenje Ion vezivanje
Ion vezivanje Aktivacijska energija
Aktivacijska energija Značajke strukture atoma metala
Značajke strukture atoma metala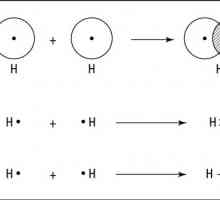 Predmet i zadaci kemije. Opća kemija. Organska kemija
Predmet i zadaci kemije. Opća kemija. Organska kemija Strukturna formula je grafički prikaz tvari
Strukturna formula je grafički prikaz tvari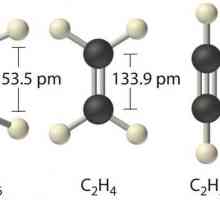 Kemijska veza: definicija, vrste, klasifikacija i značajke definicije
Kemijska veza: definicija, vrste, klasifikacija i značajke definicije Kovalentna nepolarna veza je kemijska veza koju čine identični atomi
Kovalentna nepolarna veza je kemijska veza koju čine identični atomi
 Donja-akceptorska veza: primjeri tvari
Donja-akceptorska veza: primjeri tvari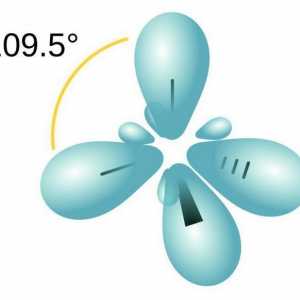 Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije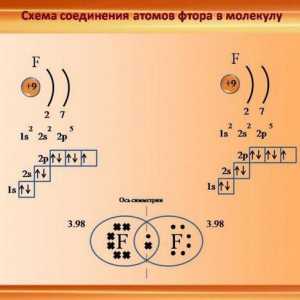 Karakteristike kovalentne veze. Za one tvari je kovalentna veza
Karakteristike kovalentne veze. Za one tvari je kovalentna veza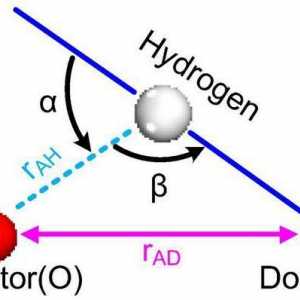 Vodikova veza: primjeri i vrste kemijskih veza
Vodikova veza: primjeri i vrste kemijskih veza