Agregatno stanje solja soli. Tablica sol, kemija
Više od 10 milijuna organskih i više od 500 tisuća anorganskih spojeva poznatih kemičarima do danas. Među njima su složeni strukture i svojstva, koji se koriste samo za kemijske ili medicinske svrhe. A postoje i oni koji uopće nisu komplicirani i vrlo česti u svakodnevnom životu. Ali to nije manje važno i značajno. U jednu od tih tvari je sol sol. U svakodnevnom životu zove se hrana, au kemijskoj industriji se naziva natrijev klorid ili natrijev klorid. U tehnološkoj industriji se naziva mineral koji se oblikuje u prirodi - haliti, kao i sol kamena ili tvrda sol. Razmotrimo detaljnije agregatno stanje stanične soli, strukture, svojstava, ekstrakcije, primjene i povijesti uvođenja u masovnu potrošnju.
sadržaj

U kojim državama postoji sol?
Što je agregatno stanje tvari i kako se to događa? Ovisi o tome koja je materija uključena. Svaki učenik iznad 7. razreda može nazvati agregatno stanje soli soli, jer to je tvar koja se nalazi u svakoj kući. Danas, bez nje, suvremenoj osobi teško je zamisliti svoj život. Dodatno, agregatno stanje stola soli sasvim je očigledno golim okom - mali ili veliki raspršeni kristali pravilnog kubičnog oblika. Međutim, otapanje soli u vodi, već ćemo ga dobiti u drugom agregatnom stanju - tekućini. Dobit ćemo isti rezultat ako jednostavno rastopimo kristale na visokoj temperaturi. Jedini uvjet koji nije karakterističan za sol je plinoviti. Ali pod određenim uvjetima, možete ga dobiti.
Uvjeti za promjenu agregatne države
- Za dobivanje soli u tekućem stanju, taljenjem krutih kristala prirodnog porijekla, temperatura od 800okoS.
- Da bi se sol prenijeli u plinovito stanje, rastopljeni kristali se moraju kuhati (oko 1400okoC) i kuhati do potpunog prijelaza strukturnih komponenata u ione (Na+ i CL-).
- Čvrsta agregatna stanična sol je prirodni oblik u prirodnim uvjetima.

Zašto se takva širenje temperature događa kada manipulira kristalima? To se objašnjava strukturom kristalne rešetke.
Kristalna rešetka
To je redoviti kubni prozirni kristal u središtu lica. U svakom kutu kocke (mjestima rešetke) izmjenjuju se pozitivno nabijeni Na ioni+ i negativno nabijenih iona CL-. Zbog oštro različite elektronegativnosti tih atoma, među njima postoji tako jaka elektrostatska atrakcija da se moraju uništiti teški uvjeti (visoka temperatura, mehanički utjecaj). takva tip kristalne rešetke zove se ionski, a karakterističan je za sve soli alkalnih, alkalijskih i prijelaznih metala.
Zato je temperatura stolne soli (i za taljenje i kuhanje) tako visoka. Međutim, kristali se mogu dobiti ne samo u kubičnom obliku, već i na piramidalnim (osam, dvanaest i dvadesetjedan) kristala. Da biste to učinili, jednostavno podesite temperaturu isparavanja slane otopine na određeni način. U svakom slučaju, unutrašnja šupljina kristala ostaje napunjena tekućinom, ako je otopina soli u vodi.

Kemijska formula natrijevog klorida je jednostavna i izražena elementarnim sastavom NaCl.
Fizička svojstva halita
Fizička svojstva natrijevog klorida mogu se opisati na nekoliko mjesta:
- Kruti kristali bijele, ružičaste, plave, ljubičaste, crvene. Boja ovisi o prisutnosti nečistoća tijekom ekstrakcije. Čista supstanca kristalne bijele boje.
- Otapa se u vodi u omjeru od oko 100/30 (u 100 g vode 30 g soli). Dobra topljivost je zbog prisutnosti dipolova vode, koji povezuju iona natrija i klora oko njih, uzrokujući uništavanje elektrostatske privlačnosti između njih i, kao posljedica toga, uništenje kristalne rešetke.
- Zagrijava i kuha na visokim temperaturama (800-1400okoC).
- Ima suptilan, ugodan miris.
- Salati na nepcu.

Kemijska svojstva natrij klorida
Kao i svaka topljiva srednja sol, natrijev klorid može komunicirati s:
- Ostale soli u reakciji razmjene (obvezno stanje: reakcija evolucije plina, taloženje ili stvaranje malodissocompatibilne tvari): NaCL + AgNO3 = NaNO3 + AgCL (bijeli sirupni talog). Ovo je kvalitativna reakcija na ion CL-.
- S metalima, stojeći u EHRNM lijevo od natrija: K + NaCL = KCL + Na.
- Disocira u vodenoj otopini u slobodne hidratirane dipolove vodenih iona: NaCL (voda rr) = Na+ + CL-. Kao rezultat toga, nastaje otopina zajedničke soli, koja je jak elektrolit.
- Ne utječe na hidrolizu, budući da je to sol koja nastaje jakom kiselinom i jakom bazom.
- Tijekom elektrolize (učinak električne struje) razgrađuje se kako bi se stvorili slobodni proizvodi i kaustična soda (kaustična): NaCL = Na + Cl2 + NaOH.
Gdje u prirodi sadrži natrijev klorid?
Za sada, sol stolice je tvar koja se često nalazi u prirodi. I iako je uvijek bilo tako, ali u antičkim vremenima i vremenima srednjeg vijeka smatra se vrlo skupim proizvodom. Sve to iz činjenice da nisu znali izvući sol iz prirodnih izvora. I postoji mnogo takvih izvora u svjetskim rezervama - halite se smatra gotovo neograničenim prirodnim resursom. Gdje je sol u prirodi?
- Morska mora i oceani slanom vodom.
- Slana jezera.
- Slane izvore.
- Podzemna voda.
- Vode u ušima.

Ekstrakcija halita
Ekstrakcija i prerada soli imaju vlastitu tehnologiju, jer jednostavno minirana tvar najčešće nije prikladna za upotrebu zbog visokog udjela stranih nečistoća. Nabavite galit drugačije, na primjer:
- podzemnim radovima;
- od šavova na dnu slanih jezera;
- isparavanje ili zamrzavanje slane morske ili oceanske vode;
- isparavanje podzemnih voda.
Bilo koja metoda omogućuje dobivanje halitnih kristala. Međutim, za prehranu u hrani mora se podvrgnuti drugoj vrsti liječenja - brušenja. Uostalom, gotovo nitko ne koristi doma kuhajući veliki kristal stolne soli. Najčešće se kupuje u već pročišćenim od nečistoća, slomljen gotovo u obliku praha. Također postoje vrste soli jodizirane, fluorirane i tako dalje, ne samo za hranu, ali i za tehničke svrhe.
Primjena kamene soli
Područja primjene i upotrebe natrij klorida su vrlo opsežne. Glavni su, zajedno s primjerima i rezultatima, navedeni u tablici.
| industrija | Osnova za upotrebu soli | rezultat |
| izgradnja krajolik | Omekšavanje tla na niskim temperaturama i uklanjanje curenja vode | Izgradnja kanalizacijskih kanala i rezervoara |
| medicina | Sličnost otopine soli s ljudskom krvlju. Otopina natrijevog klorida (0,85%), nazvana fiziološkom | Obnova ravnoteže krvi nakon opsežnog gubitka krvi, normalizacije natrijeve kalijeve pumpe u kardiovaskularnom sustavu, održavanje konstantnosti sastava želučanog soka |
| kemijski | Sinteza praktički značajnih tvari na osnovi sirovog natrijevog klorida | Dobiti: natrijev hidrogenkarbonat, klorovodična kiselina, metalni natrij, klor, natrijev hidroksid, staklo, plastika, sapun, papir i drugi proizvodi |
| hrana | Antiseptičko i antibakterijsko djelovanje soli | Očuvanje proizvoda (meso, riba, povrće), poboljšanje okusa hrane |
| metalurški | Fizička i kemijska svojstva soli | Dobivanje aluminijskih, solnih baterija, filtera |
| koža | Antiseptičko i antibakterijsko djelovanje soli | Obrada krzna i sirove kože sa suncem |
Povijest izgleda u svakodnevnom životu
Sol se nije pojavio na stolovima u svakom domu. Jednom kada je cijenjena u težini zlata, iu najizravnijem smislu. Već u 18. stoljeću, neki afrički narodi razmijenili su pregršt soli za pregršt zlatnog pijeska. Malo kasnije u Etiopiji, barovi soli bili su standardna valuta. U drevnom Rimu, vojni legionari čak su izdali mjesečnu plaću s tom supstancom, što je na kraju dovelo do imenovanja njihovih vojnika. Djeca siromašnih afričkih naroda jednostavno su lizali kamene komade stolne soli kao poslasticu. U Nizozemskoj se koristila za kažnjavanje kriminalaca, zbog mučenja. Ucinitelj nije uopce davao sol, a osoba je umrla u kratkom vremenu.
Prvi put dodjeljuju i konzumiraju ovu tvar koju su ljudi naučili u davnim vremenima. Tada je otkriveno da se sol nalazi u biljkama. Stoga su bili spaljeni, a pepeo je korišten kao začin. Kasnije su u Kini naučili kako isparavati sol iz morske vode, a proces razvoja metoda za njegovo dobivanje počeo se brže kretati.

U Rusiji je sol izvađena iz jezera (najpoznatije) slana jezera Rusija je još uvijek - Elton i Baskunchak). Tada je komercijalno značenje tvari bilo vrlo rijetko. Proizvedio ga je samo nekoliko trgovaca, koji su tada prodavali po pretjeranim cijenama. Samo bogati i slavni ljudi mogu priuštiti da imaju sol. S vremenom su se proizvodnja i proizvodnja poboljšali. Počele su se koristiti razne metode ekstrakcije i prerade, a do danas jedna od najčešćih kućanskih tvari je natrijev klorid. Kemija ovog spoja, njegova svojstva, njegova primjena u medicini i drugim granama postala je poznata približno od XVI-XVII stoljeća.
Studij u školskom tečaju
Istraživanje strukture i agregatnog stanja, kao i kemijska svojstva sol stolice, započinje s klupom škole, u okviru discipline poput kemije (8. razred). Soli u školskom tečaju proučavaju se u svojoj raznolikosti prirode. Studenti dobivaju ideju o kemijskoj osnovi, empirijskim formulama, osnovnim fizičkim i kemijskim svojstvima. Za jednostavnost i praktičnost sjećanja na formule i fizička svojstva Na letku lista udžbenika obično postoje soli, čija tablica daje ideju o njihovoj topljivosti u vodi. Tamo možete pronaći informacije o topljivosti kiselina, baza i lužina.

Važna karakteristika soli je njihova debljina, na temelju kojih je također izgrađena njihova ekstrakcija u prirodi. Lako je studentima pronaći svoje ležajeve prilikom rješavanja problema slane otopine. Tablica i grafički prikazi omogućuju ne samo vidjeti, nisko topljivi materijal ili vatrostalni, već i odrediti približnu talište i ključanje. Tipično, takve tablice se također nalaze u udžbenicima ("Chemistry", 8 klasa). Soli se trebaju proučavati u kontekstu takvih znanosti kao što su biologija i fizika. Stoga se mnogi zadaci za učenike temelje na integraciji intersubjektivnih komunikacija.
 Što su binarnim vezama?
Što su binarnim vezama? Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari
Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari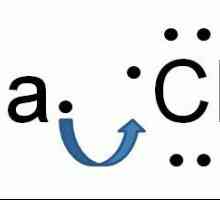 Formula soli je kuharica. Kemijska formula: sol sol. Svojstva soli u obliku tablice
Formula soli je kuharica. Kemijska formula: sol sol. Svojstva soli u obliku tablice Što je agregatno stanje? Agregatno stanje materije
Što je agregatno stanje? Agregatno stanje materije Natrij karbonat, natrijev hidrogenkarbonat - najzanimljiviji
Natrij karbonat, natrijev hidrogenkarbonat - najzanimljiviji Natrijev acetat
Natrijev acetat Ferroklorid
Ferroklorid Dvostruke soli: primjeri i nazivi
Dvostruke soli: primjeri i nazivi Kako se tvari prelaze iz tekućeg stanja u čvrsto stanje?
Kako se tvari prelaze iz tekućeg stanja u čvrsto stanje?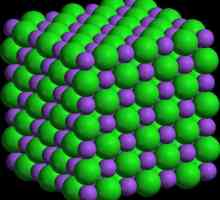 Što je materija: klase, karakteristike, svojstva. Fizička svojstva tvari
Što je materija: klase, karakteristike, svojstva. Fizička svojstva tvari Kako se koristi natrij oleat?
Kako se koristi natrij oleat? Klorovodična kiselina
Klorovodična kiselina Agregatno stanje materije
Agregatno stanje materije Termofizička svojstva, toplinska vodljivost sol stolne soli
Termofizička svojstva, toplinska vodljivost sol stolne soli Fizička svojstva halogena. Značenje, struktura, uporaba halogena
Fizička svojstva halogena. Značenje, struktura, uporaba halogena Karakteristike bora kemijskog elementa
Karakteristike bora kemijskog elementa Kiseline
Kiseline Dušična kiselina. Kemijska i fizikalna svojstva
Dušična kiselina. Kemijska i fizikalna svojstva Natrijev sulfid
Natrijev sulfid Kemijska svojstva soli i postupci za njihovo dobivanje
Kemijska svojstva soli i postupci za njihovo dobivanje Oksidi. Primjeri, klasifikacija, svojstva
Oksidi. Primjeri, klasifikacija, svojstva
 Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari
Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari Formula soli je kuharica. Kemijska formula: sol sol. Svojstva soli u obliku tablice
Formula soli je kuharica. Kemijska formula: sol sol. Svojstva soli u obliku tablice Što je agregatno stanje? Agregatno stanje materije
Što je agregatno stanje? Agregatno stanje materije Dvostruke soli: primjeri i nazivi
Dvostruke soli: primjeri i nazivi Kako se tvari prelaze iz tekućeg stanja u čvrsto stanje?
Kako se tvari prelaze iz tekućeg stanja u čvrsto stanje? Što je materija: klase, karakteristike, svojstva. Fizička svojstva tvari
Što je materija: klase, karakteristike, svojstva. Fizička svojstva tvari Kako se koristi natrij oleat?
Kako se koristi natrij oleat?