Otopina klorovodične kiseline: svojstva i primjena
Što je otopina klorovodične kiseline? To je spoj vode (H20) i klorovodik (HCl), koji je bezbojni termalni plin s karakterističnim mirisom. Kloridi se otapaju i otapaju u ionima. Klorovodična kiselina je najpoznatiji spoj koji tvori HCl, pa ćete o tome detaljno opisati.
sadržaj

opis
Otopina klorovodične kiseline pripada klasi jakih kiselina. Bezbojna, čista i korozivna. Iako tehnička kloridna kiselina ima žućkastu boju zbog prisutnosti nečistoća klor, željezo i drugih elemenata. U zraku to "puši".
Treba napomenuti da je ta tvar prisutna u tijelu svake osobe. U želucu, točnije, u koncentraciji od 0,5%. Zanimljivo je da je taj iznos dovoljan da potpuno uništi oštricu britve. Tvar će ga pojesti za samo tjedan dana.
Nasuprot istom sumpornom, usput, masa klorovodične kiseline u otopini ne prelazi 38%. Možemo reći da je ovaj pokazatelj "kritična" točka. Ako počnete povećavati koncentraciju, tvar će jednostavno ispariti, što dovodi do vodika klora koji se jednostavno upari vodom. Osim toga, ova koncentracija ostaje samo na 20 ° C. Što je temperatura veća, to je isparavanje brže.
Interakcija s metalima
Otopina klorovodične kiseline može ući u mnoge reakcije. Prije svega, s metalima koji stoje pred vodikovim nizom elektrokemijskih potencijala. Ovo je redoslijed u kojem elementi prolaze s povećanjem takve intrinzične mjere kao i elektrokemijski potencijal (phi-0). Ovaj pokazatelj je izuzetno važan u polureakciji smanjenja kationa. Osim toga, ova serija pokazuje aktivnost metala, koje se očituju u reakcijama smanjenja oksidacije.
Dakle, interakcija s njima dolazi s evolucijom vodika u obliku plina i stvaranjem soli. Evo primjera reakcije s natrijem, mekim alkalnim metalima: 2Na + 2HCl → 2NaCl + H2uarr-.
Kod drugih tvari, interakcija se nastavlja prema sličnim formulama. Tako reagira s aluminijem, laganim metalima: 2Al + 6HCl → 2AlCl3 + 3H2uarr-.

Reakcije s oksidima
S tim tvarima, otopina klorovodične kiseline također savršeno djeluje. Oksidi su binarni spojevi elementa s kisikom, s oksidacijskim stupnjem od -2. Svi poznati primjeri su pijesak, voda, hrđa, boje, ugljični dioksid.
Klorovodična kiselina ne reagira sa svim spojevima, već samo s metalnim oksidima. Kao rezultat reakcije, formira se i topiva sol i voda. Primjer je postupak koji se odvija između kiseline i magnezijeva oksida, zemnoalkalijskog metala: MgO + 2HCl → MgCl2 + H2O.
Reakcije s hidroksidima
Tzvani anorganski spojevi, u sastavima od kojih postoji hidroksilna skupina -OH, u kojoj su vodikovi i atomi kisika povezani kovalentnom vezom. I budući da solna sol otopine reagira samo s metalnim hidroksidima, vrijedno je spomenuti da se neki od njih nazivaju alkalijama.
Tako se dobivena reakcija naziva neutralizacija. Njegov rezultat je stvaranje blago disocijacijske tvari (tj. Vode) i soli.
Primjer je reakcija malog volumena otopine klorovodične kiseline i barijevog hidroksida, mekog zemnoalkalnog duktilnog metala: Ba (OH)2 + 2HCl = BaCl2 + 2H2O.

Interakcija s drugim tvarima
Uz gore navedeno, klorovodična kiselina također može reagirati s drugim vrstama spojeva. Konkretno, s:
- Soli metala, koje su formirane od drugih, slabijih kiselina. Evo primjera jedne takve reakcije: Na2ko3 + 2HC1 2NaCl + H2O + CO2uarr-. Ovdje, interakcija sa soli koja nastaje ugljičnom kiselinom (H2CO3).
- Jako oksidirajuća sredstva. S manganovim dioksidom, na primjer. Ili s kalijevim permanganatom. Takve reakcije prate oslobađanje klora. Evo jedan primjer: 2KMnO4 +16HCl-5Cl2uarr- + 2MnCl2 + 2KCl + 8H2O.
- Amonijak. Ovo je vodikov nitrid s formulom NH3, što je bezbojni, ali oštro mirisni plin. Posljedica njegove reakcije s otopinom klorovodične kiseline je masa gustog bijelog dima koji se sastoji od malih kristala amonijevog klorida. Ono što je, usput rečeno, svima poznato kao amonijak (NH4Cl). Reakcijska formula je sljedeća: NH3 + HCl → NH4CL.
- Srebrni nitrat - anorganski spoj (AgNO3), što je sol dušične kiseline i srebrnog metala. Zbog dodira s otopinom klorovodične kiseline javlja se kvalitativna reakcija - nastanak usporenog mulja srebrnog klorida. Ono se ne otapa u dušičnim. Izgleda ovako: HCL + AgNO3 → AgCldarr- + HNO3.
Priprema tvari
Sada možete razgovarati o tome što se radi u obliku klorovodične kiseline.
Prvo, spaljivanjem vodika u kloru dobiva se glavna komponenta - plinovodik. Ono se zatim otopi u vodi. Rezultat ove jednostavne reakcije je stvaranje sintetske kiseline.
Druga tvar može se dobiti od abge. To su kemijski otpadni plinovi. Oni se formiraju u različitim procesima. Na primjer, prilikom kloriranja ugljikovodika. Vodikov klorid u njihovom sastavu naziva se abgas. I dobivena kiselina na ovaj način, respektivno.
Valja napomenuti da je u posljednjih nekoliko godina udio plina u ukupnom volumenu svoje proizvodnje u porastu. A kisela, nastala kao rezultat izgaranja vodika u kloru, zamijenjena je. Međutim, radi pravde treba napomenuti da sadrži manje nečistoća.

Primjena u svakodnevnom životu
U mnogim proizvodima za čišćenje koje ljudi koji redovito koriste kućanstvo, postoji određena količina otopine klorovodične kiseline. 2-3 posto, a ponekad i manje, ali on je tamo. Zbog toga, dovođenje vodovodne opreme (npr. Pranje pločica), morate nositi rukavice. Visoka kiselinska sredstva mogu oštetiti kožu.
Još jedno rješenje se koristi kao sredstvo za uklanjanje mrlja. Pomaže da se riješite tinte ili hrđe na odjeći. Ali da je učinak uočljiv, potrebno je koristiti koncentriraniju tvar. Učinit će otopina klorovodične kiseline u 10%. Usput, izvrsno šljam.
Važno je pravilno pohranjivati tvar. Sadrži kiselinu u staklenim posudama i na mjestima gdje životinje i djeca ne mogu doseći. Čak i slaba otopina, zarobljena na koži ili sluznici, može uzrokovati kemijske opekline. Ako se to dogodi, odmah isperite površine vodom.
Na području gradnje
Korištenje klorovodične kiseline i njenih otopina je popularan način poboljšanja raznih procesa gradnje. Na primjer, često se dodaje u betonsku smjesu kako bi se povećala otpornost na mraz. Osim toga, tako se smrzava brže, a otpor zidova prema vlazi raste.
Koristi se više klorovodične kiseline, kao sredstva za čišćenje vapna. Njegovo 10 posto rješenje je najbolji način rješavanja prljavštine i tragova na crvenoj opeke. Nije ga preporučljivo koristiti za čišćenje drugih. Struktura ostalih opeka je osjetljivija na djelovanje ove supstance.

U medicini
U ovoj sferi tvar se također aktivno koristi. Razrijeđena klorovodična kiselina ima sljedeće učinke:
- Dijelovi u proteinima želuca.
- Zaustavlja razvoj malignih tumora.
- Pomaže u liječenju raka.
- Normalizira ravnotežu između kiselina i baze.
- Služi kao sredstvo za spektakularne prevenciju hepatitisa B, dijabetes, psorijaza, ekcemi, reumatoidni artritis, žučnih kamenaca, rosacea, astma, urtikarija, i mnoge druge bolesti.
Općenito, korisni lijek. Ako osoba ima nisku kiselost želučanog soka, neće prestati piti niz lijekova koji sadrže klorovodičnu kiselinu. Dobar izbor je Orto Taurine Ergo. Povećava razinu klorovodične kiseline u okruženju želuca, pomaže u borbi protiv bakterija i parazita.
Ideja je došla na um kako bi razrijedila kiselinu i koristila ga unutra u ovom obliku, a ne u sastavu lijekova? Ova praksa, ali je strogo zabranjeno to učiniti bez medicinskih savjeta i uputa. Neispravno izračunavanje proporcija, možete progutati višak otopine klorovodične kiseline i samo zapaliti želudac.
Usput, još uvijek možete uzeti lijekove koji stimuliraju proizvodnju ove tvari. I ne samo kemijski. Isti zrak, paprena metvica i pelina pridonose tome. Odbacivanje na temelju njih može se obaviti sami i piti ga za prevenciju.

Opekline i trovanje
Bez obzira koliko je učinkovit ovaj alat, to je opasno. Klorovodična kiselina, ovisno o koncentraciji, može izazvati kemijske opekline od četiri stupnja:
- Postoji samo crvenilo i bol.
- Pojavljuju se mjehurići s bistrom tekućinom i oteklinom
- Formira se nekroza gornjih slojeva kože. Mjehurići su ispunjeni krvlju ili blatnim sadržajem.
- Poraz dostiže tetive i mišiće.
Ako je tvar nekako ušla u oči, isperite ih vodom, a zatim s otopinom soda. Ali u svakom slučaju, prvo što trebaš nazvati hitnu pomoć.
Unos kiseline iznosi akutnu bol u prsima i trbuhu, oticanje grkljana, povraćanje krvavih masa. Posljedica toga je teška patologija jetre i bubrega.
A za prvih znakova trovanja para uključuju suhu česte kašalj, astmu, oštećenje zuba, peckanje u sluznicu i bol u trbuhu. Prvi pomoć u hitnim slučajevima je pranje i ispiranje usta vodom, kao i pristup svježem zraku. Samo toksikolog može pružiti stvarnu pomoć.
 Ortofosforna kiselina: uporaba i sigurnost
Ortofosforna kiselina: uporaba i sigurnost U kojim slučajevima konstanta disocijacije nema smisla?
U kojim slučajevima konstanta disocijacije nema smisla? Bakar klorid
Bakar klorid Interakcija kiselina s metalima. Interakcija sumporne kiseline s metalima
Interakcija kiselina s metalima. Interakcija sumporne kiseline s metalima "Acidin pepsin" - sredstvo za bolju probavu
"Acidin pepsin" - sredstvo za bolju probavu Proizvodnja sumporovodika, njegova svojstva, primjena
Proizvodnja sumporovodika, njegova svojstva, primjena Reakcija interakcije CaCl2, H2S04
Reakcija interakcije CaCl2, H2S04 Klorovodična kiselina
Klorovodična kiselina Kloroksid
Kloroksid Jake kiseline u svakodnevnom životu
Jake kiseline u svakodnevnom životu Hidrofluorna kiselina
Hidrofluorna kiselina Klorovodična kiselina: fizikalna i kemijska svojstva, proizvodnja i uporaba
Klorovodična kiselina: fizikalna i kemijska svojstva, proizvodnja i uporaba Kiseli kisik: kratki opis tvari
Kiseli kisik: kratki opis tvari Sumporna kiselina. Kemijska svojstva, proizvodnja
Sumporna kiselina. Kemijska svojstva, proizvodnja Hidrobromna kiselina. Metode pripreme, fizikalna i kemijska svojstva
Hidrobromna kiselina. Metode pripreme, fizikalna i kemijska svojstva Propanoična kiselina. Fizička i kemijska svojstva. Primjena, zaštita na radu.
Propanoična kiselina. Fizička i kemijska svojstva. Primjena, zaštita na radu. Klorna kiselina - svojstva, proizvodnja, primjena. Mjere opreza za rad
Klorna kiselina - svojstva, proizvodnja, primjena. Mjere opreza za rad Kemijska svojstva kiselina
Kemijska svojstva kiselina Palmitinska kiselina. Svojstva, proizvodnja, primjena
Palmitinska kiselina. Svojstva, proizvodnja, primjena Dušična kiselina. Kemijska i fizikalna svojstva
Dušična kiselina. Kemijska i fizikalna svojstva Valencija mangana. Svojstva kemijskih elemenata
Valencija mangana. Svojstva kemijskih elemenata

 Interakcija kiselina s metalima. Interakcija sumporne kiseline s metalima
Interakcija kiselina s metalima. Interakcija sumporne kiseline s metalima Proizvodnja sumporovodika, njegova svojstva, primjena
Proizvodnja sumporovodika, njegova svojstva, primjena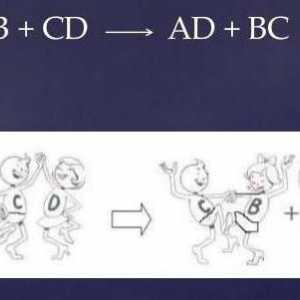 Reakcija interakcije CaCl2, H2S04
Reakcija interakcije CaCl2, H2S04