Kemijski element stroncija je opis, svojstva i formula
Stroncij (Sr) - element zemnoalkalijski metal iz grupe 2 periodičkog. Koristi se u crvenim signalnim svjetlima i fosforima, što je glavni zdravstveni rizik u radioaktivnom onečišćenju.
sadržaj
Povijest otkrića
Minerali iz olovnog rudnika u blizini sela Strontian u Škotskoj. To je bio izvorno identificiran kao vrsta barijevog karbonata, ali Adair Crawford i William Kryuykshenk 1789. godine predložio da ove druge stvari. Kemičar Thomas Charles Nada, imenovan je novi mineral strontitom u ime sela, a odgovarajuća stroncij oksid sro - stroncij. Metal je izoliran 1808. sir Humphrey Davy, koji je podvrgnut elektrolize smjese pere hidroksida ili klorida živinog oksida pomoću živinog katodu, a zatim iz dobivenog uparene merkuri amalgamom. Nazvao je novi element, koristeći korijen riječi "stroncij".

Biti u prirodi
Relativna obilje stroncija, trideset osmog elementa periodičnog stola, u prostoru se procjenjuje na 18,9 atoma svakih 106 atomi silicija. To je oko 0,04% mase zemljine kore. Prosječna koncentracija elementa u morskoj vodi je 8 mg / l.
Kemijski element stroncije široko je prisutan u prirodi, a prema stručnjacima je 15. najkupljujuća tvar na Zemlji, dosežući koncentraciju od 360 dijelova na milijun. S obzirom na ekstremnu reaktivnost, postoji samo u obliku spojeva. Glavni minerali su celestina (SrSO sulfat4) i stroncijana (SrCO karbonat3). Od njih u dovoljnim količinama za ekonomski vađenje javlja celestite, više od 2/3 svjetske ponude od kojih dolazi iz Kine i Španjolske i Meksika opskrba većinu ostatka. Međutim, povoljnije je ekstrakt stroncijana, jer je stroncij češće korišten u karbonatnom obliku, ali su poznati talogovi relativno mali.
nekretnine
Stroncij je mekan metal, sličan olovu, koji blista poput srebra na mjestu rezanja. U zraku se brzo reagira s kisikom i vlagom prisutnim u atmosferi, dobivajući žućkasto nijansu. Stoga se mora pohraniti odvojeno od zračnih masa. Najčešće se pohranjuju u kerozinu. U slobodnoj državi, ona se ne nalazi u prirodi. Prateći kalcij, stroncij je dio samo 2 osnovne rude: celestin (SrSO4) i stroncijana (SrCO3).
U nizu sustava kemijskih elemenata magnezij-kalcijev stroncij (zemnoalkalni metali) Sr u grupi 2 (bivši 2A) periodičkog između Ca i Ba. Osim toga, nalazi se u petom razdoblju između rubida i itrija. Od atomske radijusu od stroncij kalcija sličnog radijusa, to je lako zamijeniti ovog potonjeg u mineralima. Ali je mekša i više reaktivna u vodi. Nakon kontakta s njim nastaje hidroksid i plin vodik. Postoje 3 stroncijska allotropa s prijelaznim točkama od 235 ° C i 540 ° C.
 Alkalna zemlja obično ne reagira s dušikom ispod 380 ° C, a na sobnoj temperaturi nastaje samo oksid. Međutim, u obliku stroncijskog praha spontano se zapali da tvore oksid i nitrid.
Alkalna zemlja obično ne reagira s dušikom ispod 380 ° C, a na sobnoj temperaturi nastaje samo oksid. Međutim, u obliku stroncijskog praha spontano se zapali da tvore oksid i nitrid.
Kemijska i fizikalna svojstva
Karakteristike kemijskog elementa stroncije prema planu:
- Naziv, simbol, atomski broj: stroncij, Sr, 38.
- Grupa, razdoblje, blok: 2, 5, s.
- Atomska težina: 87,62 g / mol.
- Elektronska konfiguracija: [Kr] 5s2.
- Distribucija elektrona uz školjke: 2, 8, 18, 8, 2.
- Gustoća: 2,64 g / cm3.
- Tališta i vrelišta: 777 ° C, 1382 ° C.
- Stupanj oksidacije: 2.
izotopi
Prirodni strontium je smjesa od 4 stabilna izotopa: 88Sr (82,6%), 86Sr (9,9%), 87Sr (7,0%) i 84Sr (0,56%). Od njih, samo 87Sr je radiogena - nastaje tijekom propadanja radioaktivnog izotopa rubida 87Rb s Poluživot 4,88 x 1010 godine. Vjeruje se 87Sr je proizveden tijekom "primarne nukleosinteze" (rana faza Big Banga) zajedno s izotopima 84sr, 86Sr i 88Sestra Ovisno o lokaciji, omjer 87Sr i 86Sr može se razlikovati za više od 5 puta. Ovo se koristi za datiranje geoloških uzoraka i za određivanje podrijetla kostura i glinenih artefakata.
 Kao rezultat nuklearnih reakcija, dobiveno je oko 16 sintetskih radioaktivnih izotopa stroncija, od kojih je najsporniji od 90Sr (poluvrijeme života 28,9 godina). Ovaj izotop je formirana u nuklearne eksplozije, smatra se da je najopasnije proizvodi raspada. Zbog svoje kemijske sličnosti s kalcijem, on se apsorbira u kostima i zubima, gdje se nastavlja gurati elektrone, uzrokujući štetu zračenja koje narušavaju koštanu srž, narušavanja formiranje novih krvnih stanica i uzrokuju rak.
Kao rezultat nuklearnih reakcija, dobiveno je oko 16 sintetskih radioaktivnih izotopa stroncija, od kojih je najsporniji od 90Sr (poluvrijeme života 28,9 godina). Ovaj izotop je formirana u nuklearne eksplozije, smatra se da je najopasnije proizvodi raspada. Zbog svoje kemijske sličnosti s kalcijem, on se apsorbira u kostima i zubima, gdje se nastavlja gurati elektrone, uzrokujući štetu zračenja koje narušavaju koštanu srž, narušavanja formiranje novih krvnih stanica i uzrokuju rak.
Međutim, u medicinski kontroliranim uvjetima, stroncij se koristi za liječenje određenih površinskih malignih neoplazmi i karcinoma koštanog tkiva. Također se koristi u obliku stroncijum fluorida u kemijski izvori struje a termoelektrični generator, u kojem se toplina njegovog radioaktivnog raspada se pretvara u električnu energiju, posluživanje dugo traju svjetlo izvore energije u navigacijske plutače, udaljenim vremenskim postajama i svemirskih letjelica.
89Sr se koristi za liječenje raka, jer napada koštano tkivo, proizvodi beta-zračenje i nakon nekoliko mjeseci raspada (poluživot 51 dan).
Kemijski element stroncije nije nužan za veće oblike života, njegove soli su obično netoksične. Što 90Sr je opasan, koristi se za povećanje gustoće kostiju i njihovog rasta.
veze
Osobine kemijskog elementa stroncije vrlo su slične svojstva kalcija. U spojevima, Sr ima ekskluzivno oksidacijsko stanje od +2 u obliku Sr iona2+. Metal je aktivno redukcijsko sredstvo i lako reagira s halogenom, kisikom i sumporom da bi se proizveli halidi, oksidi i sulfidi.

Stroncij spojevi imaju prilično ograničenu komercijalnu vrijednost, budući da odgovarajući spojevi kalcija i barija obično izvode isti, ali su jeftinije. Međutim, neki od njih su pronašli primjenu u industriji. Nisu još došli do onih tvari za postizanje grimiznih boja u vatrometima i signalnim svjetlima. Trenutno se koriste samo stroncij soli za proizvodnju ove boje, kao što je Sr (NO nitrat3)2 i klorata Sr (ClO3)2 . Oko 5-10% ukupne proizvodnje ovog kemijskog elementa troši pirotehniku. Stroncij hidroksid Sr (OH)2 ponekad se koristi za ekstrakciju šećera iz melase jer tvori topivi saharid iz kojeg se šećer može lako regenerirati djelovanjem ugljičnog dioksida. Monosulfid SrS se koristi kao depilator i sastojak u fosforima elektroluminiscentnih uređaja i svjetlećih boja.
Stroncij feriti tvore obitelj spojeva s općom formulom SrFexOu, Reakcije koje proizlaze iz visoke temperature (1000-1300 ° C) reakcije SrCO3 i Fe2O3. Od njih se proizvode keramički magneti, koji se naširoko koriste u zvučnicima, brisačima automobila i dječjim igračkama.
proizvodnja
Većina mineraliziranog celestina SrSO4 se pretvara u karbonat na dva načina: bilo celestit izravno se ispere s otopinom natrij karbonata, ili se zagrijava ugljikom da nastane sulfid. U drugoj fazi dobiva se tamna boja koja uglavnom sadrži stroncij sulfid. Ovaj "crni pepel" otapa se u vodi i filtrira. Stroncij karbonat precipitira iz otopine sulfida uvođenjem ugljičnog dioksida. Sulfat se reducira na sulfid karbotermnom redukcijom SrSO4 + 2C → SrS + 2CO2. Element može se pripraviti elektrokemijskom kontaktom katode, naznačen time, da se ohladi željezo šipka, koja djeluje kao katoda, dodiruje površinu smjese kalijevog klorida i stroncija, i izlazi kad stroncij skrutne njima. Reakcije na elektrodama mogu se prikazati na slijedeći način: Sr2+ + 2e- → Sr (katoda) - 2Cl- → Cl2 + 2e- (anoda).
 Metalni Sr se također može dobiti iz aluminija. To je savitljiv i duktilni, dobar dirigent električne energije, ali se koristi relativno malo. Jedna od njegovih primjena je sredstvo za legiranje aluminija ili magnezija pri lijevanju blokova cilindara. Stroncij poboljšava obradivost i otpornost na puzanje metala. Alternativni način za dobivanje stroncija je smanjivanje oksida sa aluminijem u vakuumu pri temperaturi destilacije.
Metalni Sr se također može dobiti iz aluminija. To je savitljiv i duktilni, dobar dirigent električne energije, ali se koristi relativno malo. Jedna od njegovih primjena je sredstvo za legiranje aluminija ili magnezija pri lijevanju blokova cilindara. Stroncij poboljšava obradivost i otpornost na puzanje metala. Alternativni način za dobivanje stroncija je smanjivanje oksida sa aluminijem u vakuumu pri temperaturi destilacije.
Komercijalna primjena
Kemijski element stroncije široko se koristi u staklu katodnih cijevi televizora u boji kako bi se spriječio prodiranje rendgenskih zraka. Također može biti dio aerosolnih boja. Ovo, očigledno, jedan je od najvjerojatnijih izvora utjecaja stroncija na stanovništvo. Osim toga, element se koristi za proizvodnju feritnih magneta i pročišćavanje cinka.
Stroncij soli se koriste u pirotehnici, jer kada se gori, plamen je obojen u crvenoj svjetlosti. U sastavu zapaljivih i signalnih smjesa koristi se legura stroncijskih soli s magnezijem.
Titanat ima izrazito visok indeks loma i optičku disperziju, što ga čini korisnim u optici. Može se koristiti kao zamjena za dijamante, ali se rijetko koristi u tu svrhu zbog ekstremne mekoće i ranjivosti na ogrebotine.
 Stroncij aluminat je svijetlo fosfor s dugotrajnom otpornosti na fosforescenciju. Oksid se ponekad koristi za poboljšanje kvalitete keramičkih glazura. izotop 90Sr je jedan od najboljih dugogodišnjih beta-emitera visoke energije. Da se koristi kao izvor energije za termoelektrični generator (RTG), koji pretvaraju u električnu energiju topline generira raspadom radioaktivnih elemenata. Ovi uređaji koriste se u svemirskim vozilima, udaljenim vremenskim postajama, navigacijske plutače, itd - .. Gdje želite na jednostavan i dugotrajni nuklearni izvor električne energije.
Stroncij aluminat je svijetlo fosfor s dugotrajnom otpornosti na fosforescenciju. Oksid se ponekad koristi za poboljšanje kvalitete keramičkih glazura. izotop 90Sr je jedan od najboljih dugogodišnjih beta-emitera visoke energije. Da se koristi kao izvor energije za termoelektrični generator (RTG), koji pretvaraju u električnu energiju topline generira raspadom radioaktivnih elemenata. Ovi uređaji koriste se u svemirskim vozilima, udaljenim vremenskim postajama, navigacijske plutače, itd - .. Gdje želite na jednostavan i dugotrajni nuklearni izvor električne energije.
Medicinska upotreba stroncija: karakteristična svojstva, liječenje
izotop 89Sr je aktivni sastojak radioaktivnog pripravka Metastron, koji se koristi za liječenje bolova u kostima uzrokovanog metastaziranim rakom prostate. Kemijski element stroncije djeluje poput kalcija uglavnom ugrađen u kost na mjestima s povećanom osteogenezom. Ova lokalizacija fokusira se na utjecaj zračenja na rak.
radioaktivni izotop 90Sr se također koristi u terapiji raka. Njegova beta-zračenja i dugotrajni poluvrijeme života idealni su za terapiju površinskog zračenja.
Pokusni pripravak dobiven kombiniranjem stroncija s ranelinskom kiselinom potiče rast kostiju, povećava gustoću kostiju i smanjuje prijelome. Stronijev ranelat je registriran u Europi kao tretman za osteoporozu.
Stroncij klorid ponekad se koristi u zubnim pastama za osjetljive zube. Sadržaj dosegne 10%.

mjere opreza
Stroncij ima visoku kemijsku aktivnost, a u zdrobljenom stanju metal se spontano osvjetljava. Stoga se ovaj kemijski element smatra opasnošću od požara.
Utjecaj na ljudsko tijelo
Ljudsko tijelo apsorbira stronciju na isti način kao i kalcij. Ta dva elementa su kemijski toliko slični da stabilni oblici Sr ne predstavljaju značajnu prijetnju zdravlju. Nasuprot tome, radioaktivni izotop 90Sr može dovesti do raznih bolesti i bolesti kostiju, uključujući rak kostiju. Za mjerenje zračenja apsorbirane 90Sr je stroncijska jedinica.
 Kemijski element europiuma: osnovna svojstva i primjena
Kemijski element europiuma: osnovna svojstva i primjena Kakva je valencija sumpora? Moguće valencije sumpora
Kakva je valencija sumpora? Moguće valencije sumpora Molarna masa kisika. Koja je molarnu masu kisika?
Molarna masa kisika. Koja je molarnu masu kisika? Fluorni kemijski element: valencija, svojstva, svojstva
Fluorni kemijski element: valencija, svojstva, svojstva Krom, kemijski element: opis, svojstva, formula i karakteristike
Krom, kemijski element: opis, svojstva, formula i karakteristike Kemijska svojstva zemnoalkalnih metala. Primjena zemnoalkalnih metala. Fizikalna svojstva…
Kemijska svojstva zemnoalkalnih metala. Primjena zemnoalkalnih metala. Fizikalna svojstva… Kemijski element Francuske: karakteristike i povijest otkrića
Kemijski element Francuske: karakteristike i povijest otkrića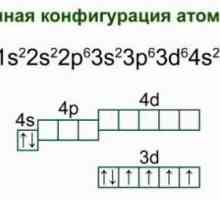 Željezo: struktura atoma, shema i primjeri. Elektronička struktura željezovog atoma
Željezo: struktura atoma, shema i primjeri. Elektronička struktura željezovog atoma Stroncij 90: poluživot. Stroncij - radionuklid
Stroncij 90: poluživot. Stroncij - radionuklid Što je najaktivniji metal?
Što je najaktivniji metal? Povijest otkrića vodika - od teorije do prakse
Povijest otkrića vodika - od teorije do prakse Fizička i kemijska svojstva vode.
Fizička i kemijska svojstva vode. Klase anorganskih spojeva
Klase anorganskih spojeva Alkalni zemni metali: kratki opis
Alkalni zemni metali: kratki opis Amfoterni metali i njihova svojstva
Amfoterni metali i njihova svojstva Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje
Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje Magnezijev hidroksid. Fizička i kemijska svojstva. Primjena.
Magnezijev hidroksid. Fizička i kemijska svojstva. Primjena. Osnovni oksidi i njihova svojstva
Osnovni oksidi i njihova svojstva Vodikov atom je najjednostavniji element
Vodikov atom je najjednostavniji element Barij hidroksid. Što znamo o njemu?
Barij hidroksid. Što znamo o njemu? Kemijski element je vrsta atoma s istim nuklearnim nabojem
Kemijski element je vrsta atoma s istim nuklearnim nabojem
 Kakva je valencija sumpora? Moguće valencije sumpora
Kakva je valencija sumpora? Moguće valencije sumpora Molarna masa kisika. Koja je molarnu masu kisika?
Molarna masa kisika. Koja je molarnu masu kisika? Fluorni kemijski element: valencija, svojstva, svojstva
Fluorni kemijski element: valencija, svojstva, svojstva Krom, kemijski element: opis, svojstva, formula i karakteristike
Krom, kemijski element: opis, svojstva, formula i karakteristike Kemijska svojstva zemnoalkalnih metala. Primjena zemnoalkalnih metala. Fizikalna svojstva…
Kemijska svojstva zemnoalkalnih metala. Primjena zemnoalkalnih metala. Fizikalna svojstva… Kemijski element Francuske: karakteristike i povijest otkrića
Kemijski element Francuske: karakteristike i povijest otkrića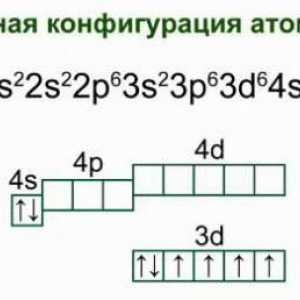 Željezo: struktura atoma, shema i primjeri. Elektronička struktura željezovog atoma
Željezo: struktura atoma, shema i primjeri. Elektronička struktura željezovog atoma Stroncij 90: poluživot. Stroncij - radionuklid
Stroncij 90: poluživot. Stroncij - radionuklid Što je najaktivniji metal?
Što je najaktivniji metal? Povijest otkrića vodika - od teorije do prakse
Povijest otkrića vodika - od teorije do prakse