Klor: Karakterizacija kemijskih i fizikalnih svojstava
U prirodi, klor se nalazi u plinovitom stanju i samo u obliku spojeva s drugim plinovima. U uvjetima koji su blizu normalne, to je otrovni, korozivni plin zelenkaste boje. Ima veću težinu od zraka. Ima slatki miris. Molekula klora sadrži dva atoma. U mirnom stanju ne gori, ali na visokim temperaturama dolazi u dodir s vodikom, nakon čega je moguće eksplozije. Kao rezultat toga, otpušta se plinski fosgen. To je vrlo otrovno. Dakle, čak i pri niskoj koncentraciji u zraku (0,001 mg po 1 dm3
sadržaj
- Povijesne činjenice
- Kemijska karakterizacija klora
- Klor: karakterizacija promjena temperature
- Klor u prirodi
- Metode za proizvodnju klora
- Korištenje klora u industrijske svrhe
- Klor kao svjetli predstavnik nemetala
- Primjena kao otrovna tvar
- Klor u životu organizama i biljkama
- Prijevoz i skladištenje klora
- Studija klora
Povijesne činjenice
Prvi put u praksi, ova tvar je dobila K. Shelee 1774. godine kombinirajući klorovodičnu kiselinu i piroluzit. Međutim, tek 1810. P. Davy je bio u mogućnosti karakterizirati klor i utvrditi da je to odvojeni kemijski element.

Valja napomenuti da je 1772 Joseph Priestley bio u mogućnosti proizvesti klorovodik, spoj klora s vodikom, ali kemičar nije mogao odvojiti ova dva elementa.
Kemijska karakterizacija klora
Klor je kemijski element glavne podskupine VII skupine periodnog stola. To je u trećem razdoblju i ima atomski broj od 17 (17 protona u atomskoj jezgri). Kemijski aktivan ne-metal. Označeno slovima Cl.
To je tipični predstavnik halogena. To su plinovi koji nemaju boje, ali imaju oštar miris. U pravilu su toksični. Svi halogeni su dobro razrijeđeni u vodi. Po kontaktu s vlažnim zrakom počinju pušiti.
Vanjska elektronska konfiguracija atoma je Cl3s2Sp5. Prema tome, u spojevima, kemijski element pokazuje razinu oksidacije od -1, + 1, +3, +4, +5, +6 i +7. Kovalentno Radijus atoma 0,96Å, radijus iona A Cl 1.83, atom elektron afinitet 3,65 eV, 12,87 eV razine ionizacije.
Kao što je prije navedeno, je prilično klor aktivan nemetal koji omogućuje stvaranje spojeva s gotovo svih metala (u nekim slučajevima i pomoću topline ili vlage prema premještanje brom) i nemetala. U obliku praha reagira s metalima samo pod utjecajem visokih temperatura.
Maksimalna temperatura izgaranja je 2250 ° C. S kisikom je u stanju formirati okside, hipoklorite, klorite i klorate. Svi spojevi koji sadrže kisik postaju eksplozivni u uvjetima interakcije s oksidirajućim tvarima. To je vrijedno napomenuti okside klora mogu eksplodirati po volji, dok klorati eksplodiraju samo kad ih netko inicira.
Karakterizacija klora po položaju u periodičkom sustavu:
• jednostavna tvar-
• element sedamnaeste grupe periodičnih tablica -
• treće razdoblje trećeg reda -
• sedma skupina glavnih pod-
• Atomski broj 17-
• označen simbolom Cl-
• kemijski aktivni ne-
• je u halogen-
• u uvjetima koji su blizu normalne, ovaj otrovni plin je žućkasto-zelena boja s pijanim mirisom,
• molekula klora ima 2 atoma (formula Cl2).

Fizička svojstva klora:
• vrelište: -34,04 ° C-
• Talište: -101,5 ° C-
• gustoća u plinovitom stanju iznosi 3, 214 g / l-
• gustoća tekućeg klora (za vrijeme vrelišta) iznosi 1,537 g / cm3-
• gustoća čvrstog klora - 1,9 g / cm3-
• Specifični volumen - 1.745 х 10-3 l / g.
Klor: Karakterizacija promjena temperature
U plinovitom stanju lako se ukapljuje. Na tlak od 8 atmosfera i temperaturu od 20 ° C izgleda kao zelenkasto-žuta tekućina. Ima vrlo visoku svojstva korozije. Kao što pokazuje praksa, taj kemijski element može održavati tekuću temperaturu do kritične temperature (143 ° C) pod uvjetom da se povećava tlak.
Ako se ohladi na -32 ° C, promijenit će ga agregatno stanje za tekućinu bez obzira na atmosferski tlak. S daljnjim padom temperature dolazi do kristalizacije (pri -101 ° C).

Klor u prirodi
Zemljina kora sadrži samo 0.017% klora. Skupina je u vulkanskim plinovima. Kao što je gore navedeno, tvar ima visoku kemijsku aktivnost, zbog čega se prirodno javlja u spojevima s drugim elementima. U ovom slučaju, mnogi minerali sadrže klor. Karakteristike elementa omogućuju oblikovanje stotinu različitih minerala. U pravilu, to su metalni kloridi.
Također, veliki broj je u svijetu Ocean - gotovo 2%. To je zbog činjenice da su kloridi vrlo aktivno rastvoreni i nošeni rijekama i morima. Moguće je obrnuti postupak. Klor se oprani natrag na obalu, a onda ga vjetar nosi. Zato se najveća koncentracija promatra u obalnim područjima. U sušnim područjima planeta, plin koji razmišljamo formira se uz pomoć isparavanje vode, zbog čega se pojavljuju soloneki. Svake godine oko 100 milijuna tona ove tvari se minira. No, što ne iznenađuje, jer postoje mnogi depoziti koji sadrže klor. Međutim, njegove karakteristike uvelike ovise o geografskom položaju.
Metode za proizvodnju klora
Danas postoje brojne metode za dobivanje klora, od kojih su najčešće:
1. Diafragmatska. To je najjednostavniji i jeftiniji. Slanica u elektrolizi dijafragme ulazi u anodni prostor. Dalje uz rešetku čelične katode ulazi u membranu. Sadrži malu količinu polimernih vlakana. Važna značajka ovog uređaja je protustrujna. Upravlja se od anodnog prostora do katode, što omogućuje odvojeno proizvodnju klora i likera.
2. Membrana. Najveći energetski učinkovit, ali teško implementirati u organizaciji. Slično je s dijafragmom. Razlika je u tome što su anodi i katodni prostori potpuno odvojeni membranom. Posljedično, izlaz je dva zasebna toka.
Važno je napomenuti da su karakteristike kemijske. element (klor) dobiven ovim postupcima bit će drugačiji. Više "čisto" se smatra membranskom metodom.
3. Metoda žive s tekućom katodom. U usporedbi s drugim tehnologijama, ova opcija omogućuje vam da dobijete najčišći klor.
Osnovna shema postrojenja sastoji se od elektrolizatora i pumpe koji su međusobno spojeni i amalgamski dekompozitori. Kao katoda, živa se pumpom pumpa zajedno s otopinom zajedničke soli, i kao anodno-ugljika ili grafita elektroda. Načelo instalacije je sljedeće: klor se oslobađa iz elektrolita, koji se zajedno s anolitom uklanja iz ćelije. Od posljednjeg, nečistoće i ostaci klora uklanjaju se, dopiraju halitom i vraćaju se u elektrolizu.
Zahtjevi industrijske sigurnosti i neprofitabilne proizvodnje doveli su do zamjene tekuće katode s čvrstom.

Korištenje klora u industrijske svrhe
Svojstva klora omogućuju ga aktivno u industriji. Uz pomoć ovog kemijskog elementa dobiveni su različiti organoklorni spojevi (vinil klorid, kloro-guma itd.), Lijekovi, dezinficijensi. Ali najveća niša u industriji je proizvodnja klorovodična kiselina i vapno.
Metode pročišćavanja pitke vode su naširoko koristi. Do danas, pokušavajući se odmaknuti od ove metode, zamijenivši ga s ozonizacija, jer mi smo s obzirom na tvar ima negativan utjecaj na ljudsko tijelo, također klorirana voda uništava cjevovoda. To je zbog činjenice da u slobodnom stanju Cl negativno utječe na cijevi izrađene od poliolefina. Ipak, većina zemalja preferira metodu kloriranja.

Klora se također koristi u metalurgiji. Uz pomoć, dobiva se niz rijetkih metala (niobium, tantal, titan). U kemijskoj industriji se različiti organoklorni spojevi aktivno koriste za suzbijanje korova i za druge poljoprivredne svrhe, a element se također koristi kao bjelilo.
Zbog svoje kemijske strukture, klor uništava većinu organskih i anorganskih boja. To se postiže njihovim potpunim prigušivanjem. Takav je rezultat moguć samo uz prisutnost vode, zbog toga što dolazi do procesa obezbojenja atomski kisik, koji nastaje nakon raspadanja klora: Cl2 + H2O → HCl + HClO → 2HCl + O. Ova metoda je korištena prije nekoliko stoljeća i danas je popularna.
Vrlo je popularno koristiti ovu tvar za proizvodnju organo-klorovih insekticida. Ovi poljoprivredni pripravci ubijaju štetne organizme, ostavljajući biljke netaknute. Značajan dio svih klora proizvedenih na planeti ide na poljoprivredne potrebe.

Također se koristi u proizvodnji plastike i gume. Pomoću njihove pomoći izrađuju se izolacije žica, pribora, opreme, školjki kućanskih aparata itd. Postoji mišljenje da gume dobivene na taj način štete osobi, ali to nije potvrđeno znanostima.
Treba primijetiti da su klor (karakteristična tvar se opisana detaljno ranije) i njegovi derivati, kao što su i iperit fosgen, koji se koristi u vojne primjene za kemijski rat sredstva.
Klor kao svjetli predstavnik nemetala
Nemetali su jednostavne tvari koje uključuju plinove i tekućine. U većini slučajeva električni strujni spojevi su lošiji od metala i imaju značajne razlike u fizikalno-mehaničkim svojstvima. Uz pomoć visoke razine ionizacije, moguće je formirati kovalentne kemijske spojeve. U nastavku ćemo dati opis ne-metala baziranog na primjeru klora.
Kao što je gore već spomenuto, ovaj kemijski element je plin. U normalnim uvjetima, u potpunosti nedostaju svojstva slična onima od metala. Bez vanjske pomoći, ne može komunicirati s kisikom, dušikom, ugljikom itd. Oksidirajuća svojstva se manifestiraju u vezi s jednostavnim tvarima i složenim. Odnosi se na halogene, što se očituje u kemijskim svojstvima. U spojevima s ostalim halogenom (brom, astatin, jod), oni su zamijenjeni. U plinovitom stanju, klor (njegova karakteristika je izravna potvrda toga) je lako topljiv. To je izvrstan dezinficijens. Ubija samo žive organizme, što ga čini nezamjenjivim u poljoprivredi i medicini.
Primjena kao otrovna tvar
Karakteristika atoma klora omogućuje njegovo korištenje kao otrov. Plin je prvi put korišten od strane Njemačke, 04/22/1915, tijekom Prvog svjetskog rata, kao posljedica smrti oko 15 tisuća. Čovjeka. U ovom trenutku, oboje otrovna tvar nije primjenjivo.
Dajmo kratak opis kemijskog elementa kao zagušujućeg agensa. Utječe na ljudsko tijelo kroz gušenja. Prvo iritira gornje dišne puteve i sluznicu očiju. Nasilan kašalj počinje gušenjem. Nadalje, prodiranje u pluća, plin korodi pluća, što dovodi do edema. Važno! Klor je brzo djelujuća tvar.
Ovisno o koncentraciji u zraku, simptomatologija je drugačija. Na malom održavanju osobe koja crvenilo od sluznice očiju, primjećuje se lagana zaduha ili kratki vjetar. Sadržaj u atmosferi iznosi 1,5-2 g / m3 uzrokuje težinu i akutne senzacije u prsima, tešku bol u gornjem respiratornom traktu. Također, stanje može biti popraćeno snažnom lažmanom. Nakon 10-15 minuta boravka u sobi s takvom koncentracijom klora dolazi do ozbiljne opekotine pluća i smrti. Kod grubih koncentracija, smrt je moguća unutar minute paralize gornjeg dišnog trakta.
Kod rada s ovom tvari, preporučljivo je koristiti zaštitnu odjeću, plinsku masku, rukavice.
Klor u životu organizama i biljkama
Klor je dio gotovo svih živih organizama. Posebnost je da ona nije prisutna u čistom obliku, već u obliku spojeva.
U životinjskim i ljudskim organizmima, kloridni ioni podupiru osmotsku jednakost. To je zbog činjenice da imaju najprikladniji radijus za prodiranje u membranske stanice. Uz kalijeve ione, Cl regulira ravnotežu između soli i soli. U crijevnim ionima klora stvoriti povoljno okruženje za djelovanje proteolitičkih enzima želučanog soka. Klorni kanali nalaze se u mnogim stanicama našeg tijela. Kroz njih dolazi do intercelularne izmjene fluida i održava se pH stanica. Oko 85% ukupnog volumena ovog elementa u tijelu nalazi se u međustaničnom prostoru. Iz tijela se izlučuje mokraćom. Proizvodi ga žensko tijelo u procesu dojenja.
U ovoj fazi razvoja teško je jednoznačno reći koje bolesti izazivaju klor i njegove spojeve. To je zbog nedostatka istraživanja u ovom području.
Klorni ioni su također prisutni u biljnim stanicama. Aktivno sudjeluje u razmjeni energije. Bez ovog elementa, proces fotosinteze je nemoguć. Uz pomoć, korijenje aktivno apsorbira potrebne tvari. Ali velika koncentracija klora u biljkama može imati štetan učinak (usporavanje procesa fotosinteze, zaustavljanje razvoja i rasta).
Međutim, postoje predstavnici flore koji bi mogli "družiti se" ili se barem pridružiti ovom elementu. Karakteristika ne-metala (klora) sadrži takvu stavku kao sposobnost tvari da oksidira tlo. U procesu evolucije, gore spomenute biljke, zvane halofiti, okupirali su prazne soloneke, koji su bili prazni zbog pretjeranosti tog elementa. Apsorbiraju klorne ione, a zatim ih se riješi pomoću pada jabuka.
Prijevoz i skladištenje klora
Postoji nekoliko načina za pomicanje i pohranjivanje klora. Karakteristika elementa podrazumijeva potrebu za posebnim cilindrima s visokim tlakom. Takvi spremnici imaju identifikacijsku oznaku - okomitu zelenu crta. Mjesečno, valjci se moraju temeljito oprati. Ako se klor čuva duže vrijeme, u njima se stvara visoko eksplozivni talog - dušik triklorid. U slučaju nepoštivanja svih sigurnosnih propisa moguće je spontano paljenje i eksplozija.

Studija klora
Budući kemičari trebaju biti svjesni karakteristika klora. Prema planu, 9-grupa može čak staviti laboratorijske eksperimente s tom tvari na temelju osnovnih znanja o disciplini. Naravno, nastavnik je dužan provoditi pouku u mjerama sigurnosti.
Redoslijed rada je kako slijedi: trebate uzeti bocu klora i uliti u njega male metalne strugotine. U letu, čipovi će bljesnuti jakim svjetlosnim iskrama i istodobno svijetlim bijelim dimom SbCl3. Kada se uroni u posudu s klorinskom kositrenom folijom, ona se također spontano zapali, a na dnu tikvice polako padaju pahuljice. Za vrijeme ove reakcije, pušačka tekućina - SnCl4. Kada se željezna strugotina stavi u posudu, nastaju crvene "kapi" i crveni dim FeCl3.
Zajedno s praktičnim radom, teorija se ponavlja. Konkretno, takvo pitanje kao karakterizacija klora po položaju u periodičkom sustavu (opisano na početku članka).

Kao rezultat eksperimenata, pokazalo se da element reagira aktivno na organske spojeve. Ako ste stavili u posudu s klorom vatom natopljenom u terpentin prethodno, to odmah zapalio, a tikvica oštro jata čađe. Učinkovito slatko žućkasto plamen natrij, a na zidovima kemijske tvornice postoje kristali soli. Studenti će biti zainteresirani da saznate da se, dok je još mlada kemičar, NN Semenov (kasnije dobitnik Nobelove nagrade), imaju takvo iskustvo, prikupljene iz zidova tikvice, i soli, posipati s njom kruh i pojede. Kemija je bila u pravu i nije propustila znanstvenika. Kao rezultat iskustva kemičara, uobičajena stolna sol stvarno se ispostavilo!
 Molekula vodika: promjer, formula, struktura. Koja je masa molekule vodika?
Molekula vodika: promjer, formula, struktura. Koja je masa molekule vodika? Ozon je plin plave boje. Svojstva i primjena plina. Ozon u atmosferi
Ozon je plin plave boje. Svojstva i primjena plina. Ozon u atmosferi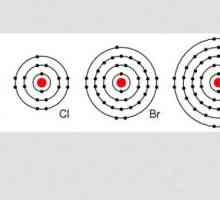 Halogeni su ... Halogeni spojevi
Halogeni su ... Halogeni spojevi Plin je ...? Svojstva, osobine, zanimljive činjenice
Plin je ...? Svojstva, osobine, zanimljive činjenice Ozon (kemijski element): svojstva, formula, oznaka
Ozon (kemijski element): svojstva, formula, oznaka Klor-dioksid: formula, primjena. Učinci kloridnog dioksida na tijelo
Klor-dioksid: formula, primjena. Učinci kloridnog dioksida na tijelo Što su halogeni? Kemijski elementi fluora, klora, joda i astata
Što su halogeni? Kemijski elementi fluora, klora, joda i astata Dužina je ta stvar? Vrste i svojstva dušika
Dužina je ta stvar? Vrste i svojstva dušika Što je fluorid? Svojstva fluora
Što je fluorid? Svojstva fluora Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari Kako dobiti od etan kloretana u organskoj kemiji
Kako dobiti od etan kloretana u organskoj kemiji Nemetali su ...? Svojstva ne-metala
Nemetali su ...? Svojstva ne-metala Klorovodična kiselina
Klorovodična kiselina Kloroksid
Kloroksid Kako odrediti stupanj oksidacije
Kako odrediti stupanj oksidacije Fizička svojstva halogena. Značenje, struktura, uporaba halogena
Fizička svojstva halogena. Značenje, struktura, uporaba halogena Ozonske rupe - problem našeg vremena
Ozonske rupe - problem našeg vremena Jednostavne tvari
Jednostavne tvari Klorna kiselina - svojstva, proizvodnja, primjena. Mjere opreza za rad
Klorna kiselina - svojstva, proizvodnja, primjena. Mjere opreza za rad Što su halogeni? Kemijska svojstva, svojstva, svojstva proizvodnje
Što su halogeni? Kemijska svojstva, svojstva, svojstva proizvodnje Klorni vapno, njegova fizička i kemijska svojstva i primjena
Klorni vapno, njegova fizička i kemijska svojstva i primjena
 Ozon je plin plave boje. Svojstva i primjena plina. Ozon u atmosferi
Ozon je plin plave boje. Svojstva i primjena plina. Ozon u atmosferi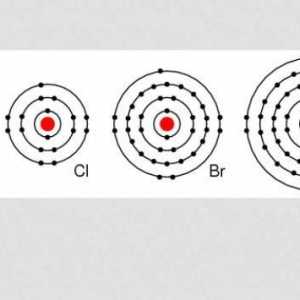 Halogeni su ... Halogeni spojevi
Halogeni su ... Halogeni spojevi Plin je ...? Svojstva, osobine, zanimljive činjenice
Plin je ...? Svojstva, osobine, zanimljive činjenice Ozon (kemijski element): svojstva, formula, oznaka
Ozon (kemijski element): svojstva, formula, oznaka Klor-dioksid: formula, primjena. Učinci kloridnog dioksida na tijelo
Klor-dioksid: formula, primjena. Učinci kloridnog dioksida na tijelo Što su halogeni? Kemijski elementi fluora, klora, joda i astata
Što su halogeni? Kemijski elementi fluora, klora, joda i astata Dužina je ta stvar? Vrste i svojstva dušika
Dužina je ta stvar? Vrste i svojstva dušika Što je fluorid? Svojstva fluora
Što je fluorid? Svojstva fluora Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari Kako dobiti od etan kloretana u organskoj kemiji
Kako dobiti od etan kloretana u organskoj kemiji