Shema strukture atoma: jezgra, ljuska elektrona. primjeri
Pogledajmo kako je atom izgrađen. Imajte na umu da će biti isključivo o modelima. U praksi, atomi su mnogo složenija struktura. No, zahvaljujući suvremenim zbivanjima, možemo objasniti i čak uspješno predvidjeti svojstva kemijskih elemenata
sadržaj
Planetarni model atoma
 Prvi je put njemački fizičar N. Bohr predložio 1913. Ovo je prva teorija strukture atoma temeljena na znanstvenim činjenicama. Osim toga, postavio je temelje za suvremenu tematsku terminologiju. U njemu elektronovi čestica proizvode rotacijske kretnje oko atoma prema istom principu kao i planeti oko Sunca. Bohr je sugerirao da mogu postojati samo u orbiti na strogo definiranoj udaljenosti od jezgre. Zašto je to tako, znanstvenik sa stajališta znanosti nije mogao objasniti, ali takav model potvrdili su mnogi eksperimenti. Da bi označili orbite, korišteni su cijeli brojevi, počevši od onog koji je numeriran, najbliži jezgri. Sve ove orbite također se nazivaju razinama. Vodikov atom ima samo jednu razinu na kojoj se jedan elektron rotira. Ali složeni atomi imaju više razina. Podijeljeni su na komponente koje kombiniraju elektrone blizu energetskog potencijala. Dakle, druga već ima dvije podgrade - 2s i 2p. Treći je već tri - 3s, 3p i 3d. I tako dalje. Prvo, naslage bliže jezgri su naseljene, a onda i udaljenije. Na svakom od njih može se staviti samo određeni broj elektrona. Ali ovo nije kraj. Svaka je podlivost podijeljena na orbite. Usporedimo se s normalnim životom. Elektronički oblak atoma usporediv je s gradom. Razine su ulice. Podrazina je privatna kuća ili stan. Orbital je soba. U svakom od njih "živi" jedan ili dva elektrona. Svi oni imaju specifične adrese. Ovo je bila prva shema strukture atoma. I napokon o adresama elektrona: određuju ih skupovi brojeva, koji se nazivaju "kvantni".
Prvi je put njemački fizičar N. Bohr predložio 1913. Ovo je prva teorija strukture atoma temeljena na znanstvenim činjenicama. Osim toga, postavio je temelje za suvremenu tematsku terminologiju. U njemu elektronovi čestica proizvode rotacijske kretnje oko atoma prema istom principu kao i planeti oko Sunca. Bohr je sugerirao da mogu postojati samo u orbiti na strogo definiranoj udaljenosti od jezgre. Zašto je to tako, znanstvenik sa stajališta znanosti nije mogao objasniti, ali takav model potvrdili su mnogi eksperimenti. Da bi označili orbite, korišteni su cijeli brojevi, počevši od onog koji je numeriran, najbliži jezgri. Sve ove orbite također se nazivaju razinama. Vodikov atom ima samo jednu razinu na kojoj se jedan elektron rotira. Ali složeni atomi imaju više razina. Podijeljeni su na komponente koje kombiniraju elektrone blizu energetskog potencijala. Dakle, druga već ima dvije podgrade - 2s i 2p. Treći je već tri - 3s, 3p i 3d. I tako dalje. Prvo, naslage bliže jezgri su naseljene, a onda i udaljenije. Na svakom od njih može se staviti samo određeni broj elektrona. Ali ovo nije kraj. Svaka je podlivost podijeljena na orbite. Usporedimo se s normalnim životom. Elektronički oblak atoma usporediv je s gradom. Razine su ulice. Podrazina je privatna kuća ili stan. Orbital je soba. U svakom od njih "živi" jedan ili dva elektrona. Svi oni imaju specifične adrese. Ovo je bila prva shema strukture atoma. I napokon o adresama elektrona: određuju ih skupovi brojeva, koji se nazivaju "kvantni".
Val modela atoma
 No s vremenom je planetarni model prošao reviziju. Predložena je druga teorija strukture atoma. To je savršeniji i omogućuje nam objašnjavanje rezultata praktičnih pokusa. Val modela atoma, predložio E. Schrodinger, zamijenio je prvi. Tada je već ustanovljeno da se elektron može očitovati ne samo kao čestica već i kao val. A što je učinio Schrodinger? Primijenio je jednadžbu koja opisuje kretanje vala u trodimenzionalni prostor. Dakle, ne može pronaći put gibanja elektrona u atomu, a vjerojatnost otkrivanja u određenom trenutku. Kombinirajući obje teorije, elementarne čestice su na određenim razinama, podskupinama i orbitalima. Na to se završava sličnost modela. Da navedemo jedan primjer - u teoriji valne orbitalna je regija u kojoj se elektron će se naći s vjerojatnošću od 95%. Na svu preostali prostor je 5% .No, na kraju se ispostavilo da su obilježja strukture atoma zastupljena s upotrebom vala modela, unatoč činjenici da je terminologija korištena je zajednička.
No s vremenom je planetarni model prošao reviziju. Predložena je druga teorija strukture atoma. To je savršeniji i omogućuje nam objašnjavanje rezultata praktičnih pokusa. Val modela atoma, predložio E. Schrodinger, zamijenio je prvi. Tada je već ustanovljeno da se elektron može očitovati ne samo kao čestica već i kao val. A što je učinio Schrodinger? Primijenio je jednadžbu koja opisuje kretanje vala u trodimenzionalni prostor. Dakle, ne može pronaći put gibanja elektrona u atomu, a vjerojatnost otkrivanja u određenom trenutku. Kombinirajući obje teorije, elementarne čestice su na određenim razinama, podskupinama i orbitalima. Na to se završava sličnost modela. Da navedemo jedan primjer - u teoriji valne orbitalna je regija u kojoj se elektron će se naći s vjerojatnošću od 95%. Na svu preostali prostor je 5% .No, na kraju se ispostavilo da su obilježja strukture atoma zastupljena s upotrebom vala modela, unatoč činjenici da je terminologija korištena je zajednička.
Koncept vjerojatnosti u ovom slučaju
 Zašto je taj pojam korišten? Heisenberg je 1927. formulirao načelo nesigurnosti, koje se sada koristi za opisivanje gibanja mikročestica. Temelji se na njihovoj temeljnoj razlici od običnih fizičkih tijela. Što je to? Klasična mehanika sugerira da osoba može promatrati pojave bez utjecaja na njih (promatranje nebeskih tijela). Na temelju dobivenih podataka možete izračunati gdje će objekt biti u određenom trenutku. Ali u mikrokozmosu posla, stvari moraju biti različite. Tako, na primjer, da promatramo elektron bez utjecaja na njega, sada nije moguće s obzirom na činjenicu da energija instrumenta i čestica nisu usporedive. To dovodi do promjene položaja elementarne čestice, stanja, smjera, brzine i drugih parametara. I besmisleno je govoriti o točnim karakteristikama. Sam princip neizvjesnosti govori nam da je nemoguće izračunati točnu putanju leta elektrona oko jezgre. Može se naznačiti samo vjerojatnost pronalaženja čestice u određenom prostoru prostora. Takva značajka ima strukturu atoma kemijskih elemenata. Ali to bi trebalo uzeti u obzir samo znanstvenici u praktičnim pokusima.
Zašto je taj pojam korišten? Heisenberg je 1927. formulirao načelo nesigurnosti, koje se sada koristi za opisivanje gibanja mikročestica. Temelji se na njihovoj temeljnoj razlici od običnih fizičkih tijela. Što je to? Klasična mehanika sugerira da osoba može promatrati pojave bez utjecaja na njih (promatranje nebeskih tijela). Na temelju dobivenih podataka možete izračunati gdje će objekt biti u određenom trenutku. Ali u mikrokozmosu posla, stvari moraju biti različite. Tako, na primjer, da promatramo elektron bez utjecaja na njega, sada nije moguće s obzirom na činjenicu da energija instrumenta i čestica nisu usporedive. To dovodi do promjene položaja elementarne čestice, stanja, smjera, brzine i drugih parametara. I besmisleno je govoriti o točnim karakteristikama. Sam princip neizvjesnosti govori nam da je nemoguće izračunati točnu putanju leta elektrona oko jezgre. Može se naznačiti samo vjerojatnost pronalaženja čestice u određenom prostoru prostora. Takva značajka ima strukturu atoma kemijskih elemenata. Ali to bi trebalo uzeti u obzir samo znanstvenici u praktičnim pokusima.
Sastav atoma
Ali usredotočimo se na cijeli objekt razmatranja. Dakle, osim dobro razmatrane elektroničke ljuske, druga komponenta atoma je jezgra. Sastoji se od pozitivno nabijenih protona i neutralnih neutrona. Svi smo upoznati s Mendelejevim stolom. Broj svakog elementa odgovara broju protona koji sadrži. Broj neutrona jednak je razlici između mase atoma i broja protona. Možda postoje odstupanja od ovog pravila. Tada kažu da postoji element izotopa. Shema strukture atoma je takva da je "okružena" elektronskom ljuskom. Broj elektrona obično je jednak broju protona. Masa potonjeg je približno 1840 puta veća od prvog, i približno je jednaka težini neutrona. Radijus jezgre je oko 1/200000 promjera atoma. I sama ima oblik sfernog. Ovo je općenito struktura atoma kemijskih elemenata. Unatoč razlikama u masi i svojstvima, izgledaju otprilike isto.
orbite
 Govoreći o shemi strukture atoma, ne možete šutjeti o njima. Dakle, postoje takve vrste:
Govoreći o shemi strukture atoma, ne možete šutjeti o njima. Dakle, postoje takve vrste:
- a. Oni imaju sferični oblik.
- str. Slični su voluminoznim likovima ili vretenom.
- d i f. Imaju složen oblik koji je teško opisati formalnim jezikom.
Elektrona svakog tipa može se naći s vjerojatnošću od 95% na području odgovarajućih orbitalnih. Prezentirane informacije trebaju biti smireno tretirane jer je prilično apstraktni matematički model, a ne fizičko stanje. No, uz sve to, ima dobru predvidljivu snagu s obzirom na kemijska svojstva atoma, pa čak i molekula. Što se jezgre nalazi dalje od razine, više elektrona se može postaviti na nju. Tako se broj orbitala može izračunati pomoću posebne formule: x2. Ovdje je x jednak broju razina. A budući da se na orbite može postaviti do dva elektrona, formula njihovog numeričkog pretraživanja konačno će izgledati ovako: 2x2.
Orbite: tehnički podaci

Ako govorimo o strukturi atoma fluora, imat će tri orbita. Svi će biti popunjeni. Energija orbita unutar istog podnožja je ista. Da biste ih označili, dodajte broj sloja: 2s, 4p, 6d. Vraćamo se u razgovor o strukturi atoma fluora. Imat će dva s- i jedan p-podlozi. Ima devet protona i isti broj elektrona. Prva s-razina. Ovo su dva elektrona. Onda druga s-razina. Još dva elektrona. I 5 ispunite p-razinu. Evo njegove strukture. Nakon čitanja sljedećeg podnaslova, možete sami raditi potrebne radnje i sami se uvjeriti. Ako govorimo fizikalna svojstva halogena, koji uključuju fluor, valja napomenuti da se, iako u istoj skupini, potpuno razlikuju po njihovim karakteristikama. Dakle, njihova vrelišna točka kreće se od -188 do 309 stupnjeva Celzijusa. Pa zašto su bili ujedinjeni? Sve zbog kemijskih svojstava. Svi halogeni, a ponajviše fluor imaju najveću sposobnost oksidacije. Oni reagiraju s metalima i bez problema se mogu samozapaljivati na sobnoj temperaturi.
Kako su ispunjene orbite?
Koje su pravila i načela elektrona? Predlažemo da se upoznate s tri osnovna, čiji je tekst pojednostavljen radi boljeg razumijevanja:
- Načelo najmanje energije. Elektroni imaju tendenciju popunjavanja orbita kako bi povećali njihovu energiju.
- Princip Paulija. Na jednom orbitalu ne može se nalaziti više od dva elektrona.
- Pravilo Hunda. Unutar jednog podmora, elektroni prvi ispunjavaju slobodne orbite, i tek tada oblikuju parove.
U području punjenja će vam pomoći periodički sustav Mendelejeva, a struktura atoma u ovom slučaju postat će jasnija u smislu slike. Stoga, u praktičnom radu s izgradnjom shema elemenata, potrebno ga je držati pri ruci.
primjer
 Da sumiramo sve rekao članka, moguće je napraviti uzorak kao atom, elektroni su raspoređeni u svojim podstupnjeva, i orbitala (tj ono što je konfiguracija razina). Može se prikazati kao formula, energetski dijagram ili kao slojevita shema. Ovdje su vrlo dobre ilustracije, koje, na bliskom pregledu, pomažu razumjeti strukturu atoma. Dakle, prvo ispunite prvu razinu. U njoj postoji samo jedna podloga, u kojoj postoji samo jedan orbital. Sve razine se popunjavaju redom, počevši od manjeg. Prvo, unutar jednog podmora, na svaki orbital stavlja se jedan elektron po elektronu. Tada su stvoreni parovi. I u prisutnosti slobodnog, dolazi do prebacivanja na drugi predmet punjenja. A sada možete samostalno znati koja je struktura dušikovog atoma ili fluora (koja je ranije bila razmatrana). U početku, to može biti malo teško, ali možete kretati kroz slike. Pogledajmo strukturu dušikovog atoma radi jasnoće. Ima 7 protona (zajedno s neutronima koji čine jezgru) i istim brojem elektrona (koji čine sastavnicu elektrona). Prvo ispunite prvu s-razinu. Ima 2 elektrona. Zatim dolazi druga s-razina. Na njemu se nalaze i dva elektrona. A druga tri su smještena na p razini, gdje svaki od njih zauzima jedan orbital svaki.
Da sumiramo sve rekao članka, moguće je napraviti uzorak kao atom, elektroni su raspoređeni u svojim podstupnjeva, i orbitala (tj ono što je konfiguracija razina). Može se prikazati kao formula, energetski dijagram ili kao slojevita shema. Ovdje su vrlo dobre ilustracije, koje, na bliskom pregledu, pomažu razumjeti strukturu atoma. Dakle, prvo ispunite prvu razinu. U njoj postoji samo jedna podloga, u kojoj postoji samo jedan orbital. Sve razine se popunjavaju redom, počevši od manjeg. Prvo, unutar jednog podmora, na svaki orbital stavlja se jedan elektron po elektronu. Tada su stvoreni parovi. I u prisutnosti slobodnog, dolazi do prebacivanja na drugi predmet punjenja. A sada možete samostalno znati koja je struktura dušikovog atoma ili fluora (koja je ranije bila razmatrana). U početku, to može biti malo teško, ali možete kretati kroz slike. Pogledajmo strukturu dušikovog atoma radi jasnoće. Ima 7 protona (zajedno s neutronima koji čine jezgru) i istim brojem elektrona (koji čine sastavnicu elektrona). Prvo ispunite prvu s-razinu. Ima 2 elektrona. Zatim dolazi druga s-razina. Na njemu se nalaze i dva elektrona. A druga tri su smještena na p razini, gdje svaki od njih zauzima jedan orbital svaki.
zaključak
 Kao što vidite, struktura atoma nije toliko težak predmet (ako ga pristupite sa stajališta tečaja kemijske kemije, naravno). A razumjeti ovu temu nije teško. Konačno, želim vas obavijestiti o nekim značajkama. Na primjer, kada govorimo o strukturi atoma kisika, znamo da ima osam protona i 8-10 neutrona. I budući da sve što je u prirodi tendira na ravnotežu, dva atoma kisika tvore molekulu u kojoj dva nezavršena elektrona tvore kovalentnu vezu. Slično, druga stabilna molekula kisika - ozon (O3). Poznavajući strukturu atoma kisika, moguće je pravilno formulirati formule za reakciju oksidacije u kojima najzastupljenija tvar sudjeluje na Zemlji.
Kao što vidite, struktura atoma nije toliko težak predmet (ako ga pristupite sa stajališta tečaja kemijske kemije, naravno). A razumjeti ovu temu nije teško. Konačno, želim vas obavijestiti o nekim značajkama. Na primjer, kada govorimo o strukturi atoma kisika, znamo da ima osam protona i 8-10 neutrona. I budući da sve što je u prirodi tendira na ravnotežu, dva atoma kisika tvore molekulu u kojoj dva nezavršena elektrona tvore kovalentnu vezu. Slično, druga stabilna molekula kisika - ozon (O3). Poznavajući strukturu atoma kisika, moguće je pravilno formulirati formule za reakciju oksidacije u kojima najzastupljenija tvar sudjeluje na Zemlji.
 Struktura atoma: što je neutron?
Struktura atoma: što je neutron? Ukratko, modeli atoma Thomsona i Rutherforda
Ukratko, modeli atoma Thomsona i Rutherforda Planetarni model Rutherforda, atom u modelu Rutherford
Planetarni model Rutherforda, atom u modelu Rutherford Struktura atoma. Kvantno-mehanički model atoma
Struktura atoma. Kvantno-mehanički model atoma Razgovarajmo o tome kako pronaći protone, neutrone i elektrone
Razgovarajmo o tome kako pronaći protone, neutrone i elektrone Osnovne informacije o strukturi atoma: karakteristike, značajke i formula
Osnovne informacije o strukturi atoma: karakteristike, značajke i formula Rutherfordov eksperiment o raspršivanju alfa čestica (ukratko)
Rutherfordov eksperiment o raspršivanju alfa čestica (ukratko) Struktura atoma
Struktura atoma Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme
Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme Što je atom promjera? Veličina atoma
Što je atom promjera? Veličina atoma Posterati Bore
Posterati Bore Struktura materije
Struktura materije Iskustvo Rutherforda
Iskustvo Rutherforda Što su valentni elektroni?
Što su valentni elektroni? Kakvo je uzbuđeno stanje atoma
Kakvo je uzbuđeno stanje atoma Rutherfordovi eksperimenti
Rutherfordovi eksperimenti Ukratko o kompleksu: struktura školjaka atoma elektrona
Ukratko o kompleksu: struktura školjaka atoma elektrona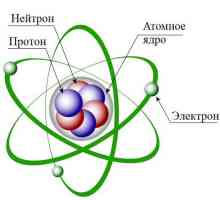 Što ovisi i na koji broj elektrona u atomu?
Što ovisi i na koji broj elektrona u atomu? Planetarni model atoma: teorijsko opravdanje i praktični dokazi
Planetarni model atoma: teorijsko opravdanje i praktični dokazi Što se sastoji od atoma bilo koje tvari?
Što se sastoji od atoma bilo koje tvari?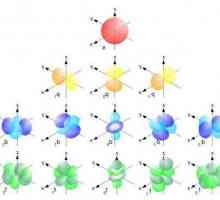 Elektronska konfiguracija - tajne strukture atoma
Elektronska konfiguracija - tajne strukture atoma
 Ukratko, modeli atoma Thomsona i Rutherforda
Ukratko, modeli atoma Thomsona i Rutherforda Planetarni model Rutherforda, atom u modelu Rutherford
Planetarni model Rutherforda, atom u modelu Rutherford Struktura atoma. Kvantno-mehanički model atoma
Struktura atoma. Kvantno-mehanički model atoma Razgovarajmo o tome kako pronaći protone, neutrone i elektrone
Razgovarajmo o tome kako pronaći protone, neutrone i elektrone Osnovne informacije o strukturi atoma: karakteristike, značajke i formula
Osnovne informacije o strukturi atoma: karakteristike, značajke i formula Rutherfordov eksperiment o raspršivanju alfa čestica (ukratko)
Rutherfordov eksperiment o raspršivanju alfa čestica (ukratko) Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme
Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme Što je atom promjera? Veličina atoma
Što je atom promjera? Veličina atoma