Ukratko, modeli atoma Thomsona i Rutherforda
Čak iu drevnoj Grčkoj, filozofi su nagađali o unutarnjoj strukturi materije. Prvi modeli strukture atoma pojavili su se već početkom 20. stoljeća. Hipoteza J. Thomsona znanstvena zajednica tada nije bila kritična, jer je pred njom već bilo predloženo različite teorije o onome što je bilo unutar najmanjih čestica materije.
sadržaj

"Puding s grožđicama", ili Thomsonov model
Do XIX. Stoljeća znanstvenici su pretpostavili da je atom nedjeljiv. Međutim, sve se promijenilo nakon što je Joseph Thomson otkrio elektron 1897. - postalo je jasno da su znanstvenici bili u krivu. Oba modela atoma Thomsona i Rutherforda bili su izneseni početkom prošlog stoljeća. Prvi je bio model W. Thomsona, koji je sugerirao da je atom grupa tvari koja ima pozitivan električni naboj. Unutar ove hrpe su uniformno raspoređeni elektroni - zato je ovaj model nazvan "torta". Uostalom, prema njemu, elektroni u materiji su raspoređeni poput grožđica u tortu. Još jedno neslužbeno ime za model je "Puding s grožđicama".

Osjećaji J. Thomsona
Ovaj je model još više razvio JJ Thomson. Za razliku od W. Thomsona, on je pretpostavljao da se elektroni u atomu nalaze strogo na jednoj ravnini, koji su koncentrični prstenovi. Unatoč jednakoj važnosti modela atoma Thomsona i Rutherforda za znanost toga vremena, treba napomenuti da je J. Thomson između ostalog predložio metodu za određivanje broja elektrona unutar atoma. Njegova se metoda temeljila na raspršenju X-zraka. J. Thomson je sugerirao da su to elektroni koji su čestice koje bi trebale biti u središtu raspršenja zraka. Osim toga, Thomson je bio znanstvenik koji je otkrio elektrone. U suvremenim školama, s proučavanjem svojih otkrića počinje proučavanje tijeka kvantne mehanike.
Minus Thomsonove teorije
Međutim, u usporedbi s Rutherfordov model, atomska modela Thomson je imao jedan značajan nedostatak. Nije mogla objasniti diskretnu prirodu atomskog zračenja. S njom je nemoguće i reći nešto o razlozima stabilnosti atoma. Konačno, to je bilo opovrgnuto kada su nastali poznati pokusi Rutherforda. Model Thomsonovog atoma nije bio manje vrijedan znanosti tog doba od ostalih hipoteza. Treba imati na umu da su svi ti modeli, dostupni u to vrijeme, bili čisto hipotetični.

Značajke eksperimenta Rutherforda
Godine 1906. - 1909. G. Geiger, E. Mardsen i E. Rutherford provode eksperimente u kojima su alfa čestice bile raspršene na površini zlatnu foliju. Ukratko, modeli atoma Thomsona i Rutherforda opisani su kako slijedi. U Thomsonovom modelu, atomi su raspoređeni neravnomjerno u atomu, a u Rutherfordovoj teoriji rotiraju se u koncentričnim ravninama. Značajni čimbenik u Rutherfordovom eksperimentu bio je korištenje alfa čestica umjesto elektrona. Alfa čestice, za razliku od elektrona, imale su znatno veću masu i nisu prolazile značajnim odstupanjima kada su se sudarali s elektronima. Stoga su znanstvenici imali priliku registrirati samo one sudare koji su se dogodili s pozitivno nabijenim dijelom atoma.

Uloga Rutherfordova otkrića
Ovo iskustvo bilo je ključno za znanost. Pomoću njegove pomoći, znanstvenici su uspjeli dobiti odgovore na ta pitanja koja su ostao misterij za autore različitih atomskih modela. Thomson, Rutherford i Bohr, iako imaju istu bazu, unatoč tomu dali su nešto drugačiji doprinos znanosti - a rezultati Rutherfordovih eksperimenata u ovom su slučaju bili zapanjujući. Njihovi rezultati bili su upravo suprotno onome što su znanstvenici očekivali.
Većina alfa čestica prolazila je kroz foliju folije duž ravnih (ili praktički ravnih) putanja. Međutim, putanje nekih alfa čestica je odstupalo od značajnih kutova. A to je bio dokaz da je u atomu postojala formacija s vrlo visokom gustoćom, i imala je pozitivan naboj. Godine 1911., temeljeno na eksperimentalnim podacima, predstavljen je model strukture atoma Rutherford. Thomson, čija je teorija ranije bila dominantna, u ovom je trenutku nastavila raditi u laboratoriju Sveučilišta Cavendish. Do kraja života znanstvenik je i dalje vjerovao u postojanje mehaničkog etera, unatoč svim napredcima u znanstvenom istraživanju toga vremena.

Planetarni model Rutherforda
Sažimajući rezultate eksperimenata, Ernest Rutherford iznijeli su glavne odredbe njegove teorije: prema njemu, atom se sastoji od teške i guste jezgre vrlo malih dimenzija - oko ove jezgre postoje elektroni koji su u kontinuiranom kretanju. Zračenja orbita tih elektrona također su mali: oni su 10-9 m. Taj je model nazvan "planetarnim" zbog svoje sličnosti s model Sunčevog sustava. U njemu se planeti kreću u eliptičnim orbitima oko ogromnog i masivnog centra, koji ima atrakciju - Sunce.
Elektroni se rotiraju u atomu s tako velikom brzinom da oblikuju oko površine atoma nešto poput oblaka. Prema Rutherfordovoj teoriji, atomi su razmaknuti jedni od drugih na nekoj udaljenosti, što im omogućuje da se ne drže zajedno. Uostalom, oko svakog od njih ima negativno nabijenu elektronsku ljusku.

Modeli atoma Thomsona i Rutherforda: glavne razlike
Koje su glavne razlike između dvije najvažnije teorije strukture atoma? Rutherford je pretpostavio da u središtu atoma postoji jezgra s pozitivnim električnim nabojem, a čiji volumen, u usporedbi s dimenzijama atoma, je zanemariv. Thomson je također pretpostavio da je cijeli atom formacija visoke gustoće. Druga velika razlika bila je razumijevanje položaja elektrona u atomu. Prema Rutherfordu, oni se okreću oko jezgre, a njihov je broj otprilike jednak frac12 je atomska masa kemijskog elementa. U Thomsonovoj teoriji, elektroni unutar atoma neravnomjerno su raspoređeni.
Minus Rutherfordove teorije
Međutim, unatoč svim prednostima, u to je vrijeme Rutherfordova teorija sadržavala jednu važnu proturječnost. Prema zakonima klasične elektrodinamike, elektron koji se okretao oko jezgre morao je stalno emitirati dijelove električne energije. Zbog toga radijus orbite na kojem se elektron pokreće mora kontinuirano emitirati elektromagnetsko zračenje. Prema tim idejama, životni vijek atoma mora biti zanemariv.
Najčešće, kada govore o otkriću unutarnje strukture atoma, spominju imena Thomsona i Rutherforda. Rutherfordovi eksperimenti, čiji je atomska model sada poznat svakom studentu fizike i matematike u visokom obrazovanju, sada je dio povijesti znanosti. Kad je Rutherford otkrio svoje otkriće, uzviknuo je: "Sada znam što izgleda atom!" Međutim, u stvarnosti je bio u krivu jer je istinska slika postala poznata znanstvenicima mnogo kasnije. Iako je model Rutherforda bio podvrgnut značajnim prilagodbama tijekom vremena, njegovo značenje ostalo je nepromijenjeno.

Bohrov model
Međutim, pored modela atoma Thomsona i Rutherforda, postojala je još jedna teorija koja objašnjava unutarnju strukturu ovih sitnih čestica materije. Pripada Nielsu Bohru - danskom fizičaru koji je 1913. ponudio svoje objašnjenje. Prema svom modelu, elektron u atomu ne poštuje standardne fizičke zakone. Bio je Bohr koji je bio znanstvenik koji je u znanost uveo pojam odnosa između radijusa elektronske orbite i njegove brzine.
U procesu stvaranja svoje teorije, Bohr je kao osnovao model Rutherforda, ali ga je podvrgnuo znatnom profinjenosti. Modeli atoma Bohra, Rutherforda i Thomsona mogu se sada činiti pomalo jednostavnima, ali su stvorili osnovu za moderne ideje o unutarnjoj strukturi atoma. Danas se kvantni model atoma općenito prihvaća. Unatoč činjenici da kvantna mehanika ne može opisati kretanje planeta Sunčevog sustava, koncept orbite do sada je ostao u teorijama koje opisuju unutarnju strukturu atoma.
 Što je elektron? Svojstva i povijest otkrivanja elektrona
Što je elektron? Svojstva i povijest otkrivanja elektrona Struktura atoma: što je neutron?
Struktura atoma: što je neutron? Što je subatomska čestica?
Što je subatomska čestica? Razina energije atoma: struktura i prijelazi
Razina energije atoma: struktura i prijelazi Koja elementarna čestica ima pozitivan naboj?
Koja elementarna čestica ima pozitivan naboj? Planetarni model Rutherforda, atom u modelu Rutherford
Planetarni model Rutherforda, atom u modelu Rutherford Struktura atoma. Kvantno-mehanički model atoma
Struktura atoma. Kvantno-mehanički model atoma Otkriće elektrona: Joseph John Thomson
Otkriće elektrona: Joseph John Thomson Koje su čestice otkrile Rutherford? Iskustvo i shema Rutherfordovog iskustva
Koje su čestice otkrile Rutherford? Iskustvo i shema Rutherfordovog iskustva Razgovarajmo o tome kako pronaći protone, neutrone i elektrone
Razgovarajmo o tome kako pronaći protone, neutrone i elektrone Koja je godina i tko je otkrio elektron? Fizičar koji je otkrio elektron: ime, povijest otkrića i…
Koja je godina i tko je otkrio elektron? Fizičar koji je otkrio elektron: ime, povijest otkrića i… Rutherfordov eksperiment o raspršivanju alfa čestica (ukratko)
Rutherfordov eksperiment o raspršivanju alfa čestica (ukratko) Struktura atoma
Struktura atoma Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme
Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme Iskustvo Rutherforda
Iskustvo Rutherforda Otkriće protona i neutrona
Otkriće protona i neutrona Elektronski naboj
Elektronski naboj Rutherfordovi eksperimenti
Rutherfordovi eksperimenti Ukratko o kompleksu: struktura školjaka atoma elektrona
Ukratko o kompleksu: struktura školjaka atoma elektrona Planetarni model atoma: teorijsko opravdanje i praktični dokazi
Planetarni model atoma: teorijsko opravdanje i praktični dokazi Što se sastoji od atoma bilo koje tvari?
Što se sastoji od atoma bilo koje tvari?
 Struktura atoma: što je neutron?
Struktura atoma: što je neutron? Što je subatomska čestica?
Što je subatomska čestica? Razina energije atoma: struktura i prijelazi
Razina energije atoma: struktura i prijelazi Koja elementarna čestica ima pozitivan naboj?
Koja elementarna čestica ima pozitivan naboj? Planetarni model Rutherforda, atom u modelu Rutherford
Planetarni model Rutherforda, atom u modelu Rutherford Struktura atoma. Kvantno-mehanički model atoma
Struktura atoma. Kvantno-mehanički model atoma Otkriće elektrona: Joseph John Thomson
Otkriće elektrona: Joseph John Thomson Koje su čestice otkrile Rutherford? Iskustvo i shema Rutherfordovog iskustva
Koje su čestice otkrile Rutherford? Iskustvo i shema Rutherfordovog iskustva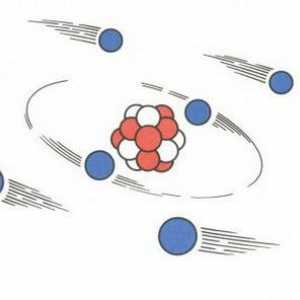 Razgovarajmo o tome kako pronaći protone, neutrone i elektrone
Razgovarajmo o tome kako pronaći protone, neutrone i elektrone Koja je godina i tko je otkrio elektron? Fizičar koji je otkrio elektron: ime, povijest otkrića i…
Koja je godina i tko je otkrio elektron? Fizičar koji je otkrio elektron: ime, povijest otkrića i…