Kemijska svojstva etilen glikola, karakteristična. Dihidrični alkohol. Etilenglikol eteri
Najpoznatije i najčešće korištene u životu čovjeka iu industriji tvari koje pripadaju kategoriji polihidričnih alkohola su etilen glikol i glicerin. Njihovo istraživanje i korištenje počeli su prije nekoliko stoljeća, ali njihova svojstva organski spojevi
sadržaj
- Prvi "poznanik" s etilen glikolom i glicerinom: povijest dobivanja
- Struktura i struktura veze
- Pripadnost klasifikaciji
- Fizičke značajke
- Metode dobivanja
- Karakterizacija općih kemijskih svojstava
- Reakcije s aktivnim metalima
- Kvalitativna reakcija na etilen glikolu
- Polimerizacija
- Zamjena hidroksila za halogen
- Priprava etera
- Najvažniji derivati etilen glikola
- Područja primjene i cjenovna politika proizvodne linije
Prvi "poznanik" s etilen glikolom i glicerinom: povijest dobivanja
U 1859. godini, u dva koraka dibromoetana interakcije sa srebrnim acetatom i naknadnom reakcijom s kalijevim hidroksidom, dobivene u prvom reakcije etilenglikola u Charles Wurtz prvo sintetizirani glikol. Nakon nekog vremena, razvili smo metodu izravnog hidrolize dibromoctanom, ali na industrijskoj razini u rano dihidroksilni alkohola dvadesetog stoljeća 1,2-dihidroksi etana, on - monoetilen glikol ili glikol, dobivene hidrolizom etilena u Sjedinjenim Državama.
Do danas, kako u industriji iu laboratoriju koristi i niz drugih metoda, nove i učinkovitije sirovina i energetskih točaka gledišta, i ekološki prihvatljivih jer uporabu reagensa koji sadrže ili oslobađa klor, toksine, kancerogene tvari, i druge štetne za okoliš i čovjeka tvar se smanjuje kao razvoj "zelene" kemije.
Apoteku Carl Wilhelm Scheele 1779. godine otkriven je glicerol, a određeni sastav tog spoja proučavao je 1836. godine Theophilus Julius Peluz. Dva desetljeća kasnije, struktura molekule ovog trihidričnog alkohola utvrđena je i opravdana u spisima Pierre Eugene Marcelia Vertello i Charlesa Wurza. Konačno, dvadeset godina kasnije, Charles Friedel izvodi kompletnu sintezu glicerina. Trenutno, industrija koristi dvije metode za dobivanje: od alil klorida iz propilena, kao i kroz akrolein. Kemijska svojstva etilen glikola, poput glicerola, široko se koriste u različitim područjima kemijske proizvodnje.
Struktura i struktura veze
Molekula se zasniva na nezasićenom ugljikovodičnom skeletu etilena, koji se sastoji od dva atoma ugljika, u kojima je dvostruka veza prekinuta. Dvije hidroksilne skupine pridružile su se oslobodenim mjestima valencije na ugljikovim atomima. Formula etilena - C2H4, nakon raskida dizalice i dodavanja hidroksilnih skupina (nakon nekoliko faza), izgleda kao C2H4(OH)2. Ovo je etilen glikol.
etilen molekule naznačen time linearnom strukturom, a dihidroksilni alkohol ima određene sličnosti trans konfigurtsii u položaj hidroksilnih skupina u odnosu na ugljikovu strukturu, a na drugi (u potpunosti taj pojam primjenjuje se u položaj u odnosu na višestrukoj vezi). Takva dislokacija odgovara najudaljenijem položaju vodika iz funkcionalnih skupina, manje energije, a time i maksimalne stabilnosti sustava. Jednostavno rečeno, jedna ON-skupina "izgleda" gore, a druga - dolje. Istovremeno su nestabilni spoj s dvije hidroksilne skupine: sa jednim ugljikovim atomom da nastane reakcijska smjesa, odmah dehidrat, prolazi u aldehide.
Pripadnost klasifikaciji
Kemijska svojstva etilen glikola određuje njezina podrijetlom iz skupine koja se sastoji od viševalentnih alkohola, odnosno podgrupa diole, tj spojeva s dvije hidroksilne grupe na susjednim atomima ugljika. Tvar koja također sadrži nekoliko OH-supstituenata je također glicerin. Ona ima tri funkcionalne skupine alkohola i najčešći je predstavnik njezine podrazrede.
Mnogi su spojevi ove klase također proizvedeni i upotrijebljeni u kemijskoj proizvodnji za različite sinteze i druge svrhe, ali uporaba etilen glikola je ozbiljnija i koristi se u gotovo svim industrijama. Ovo pitanje će se detaljnije razmotriti u nastavku.
Fizičke značajke
Korištenje etilen glikola objašnjava se prisutnošću brojnih svojstava koja su svojstvena polihidroksilnim alkoholima. To su obilježja karakteristična samo za određenu klasu organskih spojeva.
Najvažnije od svojstava je neograničena sposobnost miješanja s H2A. Voda + etilen glikol daje otopinu koja ima jedinstvenu karakteristiku: točka smrzavanja, ovisno o koncentraciji diola, niža je za 70 stupnjeva nego u čistom destilatu. Važno je napomenuti da je ta ovisnost nelinearna, a nakon dostizanja određenog kvantitativnog sadržaja glikola počinje obrnuti učinak - točka smrzavanja se povećava s porastom postotka otopljene tvari. Ova značajka je pronašla primjenu u području proizvodnje različitih antifriza, tekućina bez zamrzavanja koja kristaliziraju pri ekstremno niskim toplinskim karakteristikama okoliša.
Osim u vodi, proces otapanja dobro napreduje u alkoholu i acetonu, ali se ne opaža u parafmima, benzenima, eterima i ugljikovom tetrakloridu. Suprotno svom predaka alifatskih - plinovite tvari, kao što su etilen glikol, etilen glikol - je sirupa, proziran, s blagim primjesa žute tekućine, slatkasti okus, sa neuobičajenom mirisa, praktički trajnu. Zamrzavanje 100% etilen glikola pojavljuje se na - 12,6 stupnjeva Celzijusa i ključanje na +197,8. Pod normalnim uvjetima, gustoća iznosi 1,11 g / cm3.
Metode dobivanja
Etilenglikol se može dobiti na nekoliko načina, od kojih neki danas imaju samo povijesnu ili preparativnu vrijednost, dok su drugi aktivno iskorišteni od strane čovjeka na industrijskoj razini, a ne samo u njima. Slijedite kronološki, razmislite o najvažnijim.
Prva metoda dobivanja etilen glikola iz dibromoetana već je gore opisana. Formula etilen dvostruka veza je prekinut, a slobodna valencija zauzimaju halogena, - glavni početni materijal u toj reakciji - osim ugljika i vodika u svojoj strukturi ima dva atoma broma. Formiranje intermedijera u prvoj fazi postupka moguće je upravo zbog njihovog cijepanja, tj. Zamjene acetatnim skupinama koje se nakon hidrolize pretvaraju u alkoholne.
Tijekom daljnjeg razvoja znanosti postalo je moguće proizvesti etilen glikol izravnom hidrolizom bilo ethanes supstituiran sa dva halogena na susjednim atomima ugljika, s vodenim otopinama karbonata alkalijskih metala ili grupe (manje ekološki reagens) H2O i olovni dioksid. Reakcija prilično „težak” i javlja se samo na znatno višim temperaturama i pritiscima, ali to nije spriječilo Nijemce tijekom razdoblja svjetska rata koriste ovu metodu za proizvodnju etilena u industrijskim razmjerima.
Njegova uloga u razvoju organske kemije odigrala se metodom dobivanja etilen glikola iz etilen klorohidrina hidrolizom s ugljenim solima metala alkalne skupine. Uz povećanje temperature reakcije do 170 stupnjeva, prinos željenog produkta dostigao je 90%. No, došlo je do značajnog nedostatka - glikol je nekako trebao biti izvađen iz otopine soli, što izravno uključuje brojne poteškoće. Znanstvenici su riješili taj problem razvijanjem metode s istom početnom tvari, ali su procesu prekinuli u dvije faze.
Hidroliza etilenglikolatsetatov, kao u završnoj fazi postupka prethodno Wurtz, postaje zasebna način, kada u mogućnosti primiti sirovinama oksidaciju etilena u octenoj kiselini s kisikom, tj bez upotrebe skupih i ne bezopasan halogenih spojeva.
Također je poznato mnogo metoda za proizvodnju etilena oksidacijom etilen hidroperokside peroksidi, organske perkiseline u prisutnosti katalizatora (osmij spojevi) kalijev klorat itd. Postoje i elektrokemijske i radijacijsko-kemijske metode.
Karakterizacija općih kemijskih svojstava
Kemijska svojstva etilen glikola određena su funkcionalnim skupinama. Jedan od hidroksilnih supstituenata ili oboje mogu sudjelovati u reakcijama, ovisno o uvjetima postupka. Glavna razlika u reaktivnosti leži u činjenici da, zbog prisutnosti nekoliko hidroksila u polihidričnom alkoholu i njihovom međusobnom utjecaju, jači kiselinskim svojstvima, nego u monatomskim "kolegama". Stoga su u reakcijama s alkalnim proizvodima soli (za glikolglikolate, za glicerol - glicerate).
Kemijska svojstva etilen glikola, kao i glicerina, uključuju sve reakcije alkohola iz kategorije monatoma. Glikol daje kompletan i djelomične estere u reakcijama s monobazične kiseline, glikolne kiseline, odnosno, koje nastaju s alkalijskim metalima i kemijskim postupkom s jakim kiselinama ili soli octene kiseline objavljen aldehid - zbog cijepanjem molekula atom vodika.
Reakcije s aktivnim metalima
Interakcija etilen glikola s aktivnim metalima (stajanje nakon vodika u području kemijske napetosti) na povišenim temperaturama daje etilen glikolat odgovarajućeg metala, zajedno s vodikom koji je oslobođen.
C2H4(OH)2 + X → C2H4oh2X, gdje je X aktivni dvovalentni metal.
Kvalitativna reakcija na etilen glikolu
Razlikovati polivalentni alkohol iz bilo koje druge tekućine pomoću vizualne reakcije, karakteristične samo za ovu klasu spojeva. Za to se svježe precipitirana voda izlije u otopinu bezbojne alkoholne faze bakar hidroksid (2), koji ima karakterističnu plavu boju. Kada se miješaju komponente, dolazi do razrjeđivanja taloga i otopina se oboji zasićenom plavom bojom - kao rezultat formiranja bakrenog glikolata (2).
polimerizacija
Kemijska svojstva etilen glikola su od velike važnosti za proizvodnju otapala. Intermolekularno dehidracija spomenute tvari, tj uklanjanje vode iz svake od dvije molekule glikola i nakon toga kombiniranje (jedna hidroksilna grupa otcijepiti u potpunosti, ali s druge strane se pruža samo vodik), daje mogućnost dobivanja jedinstvene organsko otapalo - dioksan, koji se često koristi u organskoj kemiji, unatoč svojoj visokoj toksičnosti.
Zamjena hidroksila za halogen
Kada etilen glikol reagira s halogenidnim kiselinama, hidroksilne skupine se zamjenjuju odgovarajućim halogenom. Stupanj supstitucije ovisi o molarnoj koncentraciji vodikovog halogenida u reakcijskoj smjesi:
HO-CH2-CH2-OH + 2H-H-CH2-CH2-X, gdje X je klor ili brom.
Priprava etera
U reakcijama etilena s dušičnom kiselinom (definirane koncentracije) i organske kiseline (monobazični mravlja, octena, propionska, karnevala, valerijanska i t. D.) stvaranje kompleksa, te u skladu s tim, monoetera. Drugim koncentracijama dušične kiseline - i di-trinitroefirov glikol. Katalizator je sumporna kiselina određene koncentracije.
Najvažniji derivati etilen glikola
Vrijedne tvari koje se mogu dobiti iz polihidroksilnih alkohola uz pomoć jednostavnih kemijske reakcije (opisani gore) su eteri etilen glikola. Naime: monometil i monoetil, čija su formula HO-CH2-CH2-O-CH3 i HO-CH2-CH2-O-C2H5 respektivno. Kemijskim svojstvima, oni su u mnogočemu slični glikolima, ali, kao i svaka druga klasa spojeva, imaju jedinstvenu reakcijsku osobitost koja je jedinstvena za njih:
- Monometiletilenglikol tekućina bez boje, ali s karakterističnim odvratne mirisa, čireva na 124,6 stupnjeva Celzijusa, i otapanjem u etanolu i drugim organskim otapalima i u vodi znatno isparljiviji od glikola, te gustoću manju od vode (oko 0,965 g / cm3).
- Dimetiletilen glikol je također tekućina, ali s manje karakterističnim mirisom, gustoća od 0.935 g / cm3, točka vrenja je 134 stupnja iznad nule i topljivost usporediva s prethodnim homologom.
Korištenje celosolva - toliko općenito zvane monoeteri etilen glikola - vrlo je čest. Koriste se kao reagensi i otapala u organskoj sintezi. Također ih primijenite fizička svojstva za antikorozivne i antikristalizacijske aditive u antifrizu i motornim uljima.
Područja primjene i cjenovna politika proizvodne linije
Trošak tvornicama i poduzećima bavi proizvodnjom i prodaju tih kemikalija, u rasponu od prosječno oko 100 rubalja po kilogramu takvih kemijskih spojeva, kao što je etilen glikol. Cijena ovisi o čistoći tvari i maksimalnom postotku ciljnog proizvoda.
Uporaba etilen glikola nije ograničena na bilo koje područje. Dakle, kao sirovina koristi se u proizvodnji organskih otapala, umjetnih smola i vlakana, tekućina koja se zamrzavaju na negativnim temperaturama. Uključen je u mnoge industrijske sektore, poput automobila, zrakoplovstva, farmaceutske, električne, kože i duhana. Njegova važnost za organsku sintezu je neupitno značajna.
Važno je zapamtiti da je glikol toksični spoj koji može uzrokovati nepopravljivu štetu ljudskom zdravlju. Dakle, to je pohranjena u zatvorenim posudama izrađenim od aluminija ili čelika s dodatnim unutarnjim slojem štiti spremnik od korozije, samo u vertikalnom položaju i područja koja nisu obuhvaćena u sustavima grijanja, ali uz dobru ventilaciju. Trajanje - ne više od pet godina.
 Etilenoksid: proizvodnja, uporaba
Etilenoksid: proizvodnja, uporaba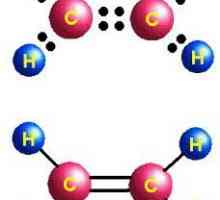 Prvi predstavnik alkena je etilen. Fizička svojstva, proizvodnja, primjena etilena
Prvi predstavnik alkena je etilen. Fizička svojstva, proizvodnja, primjena etilena Propilen glikol - što je to? Kemijska svojstva, primjena
Propilen glikol - što je to? Kemijska svojstva, primjena `Nedjelja` za grijanje: ostava, cca. `Zaštita od smrzavanja` za sustave grijanja
`Nedjelja` za grijanje: ostava, cca. `Zaštita od smrzavanja` za sustave grijanja Primjena etilena. Svojstva etilena
Primjena etilena. Svojstva etilena Gustoća antifriza ovisno o temperaturi. Je li moguće miješati antifriz različitih boja?
Gustoća antifriza ovisno o temperaturi. Je li moguće miješati antifriz različitih boja? Propilen glikol i glicerin: usporedba i šteta
Propilen glikol i glicerin: usporedba i šteta Alkadieni su tipični predstavnici nezasićenih ugljikovodika
Alkadieni su tipični predstavnici nezasićenih ugljikovodika Antifriz na bazi etilen glikola: robne marke, razlike, sastav
Antifriz na bazi etilen glikola: robne marke, razlike, sastav Proizvodnja etilena
Proizvodnja etilena Kemijska svojstva alkohola
Kemijska svojstva alkohola Dehidracija alkohola
Dehidracija alkohola Eterima. svojstvo
Eterima. svojstvo Polihidrični alkoholi: karakterizacija, proizvodnja i uporaba
Polihidrični alkoholi: karakterizacija, proizvodnja i uporaba Benzilni alkohol: svojstva, proizvodnja, primjena
Benzilni alkohol: svojstva, proizvodnja, primjena Nezasićeni ugljikovodici: alkeni, kemijska svojstva i primjena
Nezasićeni ugljikovodici: alkeni, kemijska svojstva i primjena Alkeni: formula. Kemijska svojstva. recepcija
Alkeni: formula. Kemijska svojstva. recepcija Kvalitativna reakcija na glicerin je specifična, što pomaže u otkrivanju
Kvalitativna reakcija na glicerin je specifična, što pomaže u otkrivanju Monohidrični alkoholi, njihova fizikalna i kemijska svojstva
Monohidrični alkoholi, njihova fizikalna i kemijska svojstva Antifriz crveno i ostale vrste
Antifriz crveno i ostale vrste Dobivanje alkohola: metode i sirovine
Dobivanje alkohola: metode i sirovine
 Prvi predstavnik alkena je etilen. Fizička svojstva, proizvodnja, primjena etilena
Prvi predstavnik alkena je etilen. Fizička svojstva, proizvodnja, primjena etilena Propilen glikol - što je to? Kemijska svojstva, primjena
Propilen glikol - što je to? Kemijska svojstva, primjena `Nedjelja` za grijanje: ostava, cca. `Zaštita od smrzavanja` za sustave grijanja
`Nedjelja` za grijanje: ostava, cca. `Zaštita od smrzavanja` za sustave grijanja Primjena etilena. Svojstva etilena
Primjena etilena. Svojstva etilena Gustoća antifriza ovisno o temperaturi. Je li moguće miješati antifriz različitih boja?
Gustoća antifriza ovisno o temperaturi. Je li moguće miješati antifriz različitih boja? Propilen glikol i glicerin: usporedba i šteta
Propilen glikol i glicerin: usporedba i šteta Alkadieni su tipični predstavnici nezasićenih ugljikovodika
Alkadieni su tipični predstavnici nezasićenih ugljikovodika Antifriz na bazi etilen glikola: robne marke, razlike, sastav
Antifriz na bazi etilen glikola: robne marke, razlike, sastav