Osnove anorganske kemije. Stupanj oksidacije
Stupanj oksidacije je uvjetovan naboj atoma elementa u molekuli. Ovaj koncept je temeljno u anorganskoj kemiji, bez njegovog razumijevanja nemoguće je zamisliti proces redoks reakcija, tipovi veza u molekuli, kemijskih i fizičkih svojstava elemenata. Da bi se razumjelo ono što je stupanj oksidacije je potrebno najprije razumjeti što čini samu atom i kako se ponaša u interakciji sa svojim vršnjacima.
sadržaj
Kao što je poznato, atom se sastoji od protona, neutrona i elektrona. Protoni i elektroni, koji se nazivaju i nukleoni, tvore pozitivno nabijanu jezgru oko koje se oko njega negativno elektrone okreću. Pozitivan naboj jezgre uravnotežen je ukupnim negativnim nabojem elektrona. Zbog toga je atom neutralan.
Svaki elektron ima određenu razinu energije, koja određuje blizinu svog položaja prema jezgri: bliže jezgri - manje energije. Smješteni su u slojevima. Elektroni jednog sloja imaju praktički istu rezervu energije i tvore razinu energije ili elektronski sloj. Elektroni su uključeni vanjska razina energije nisu previše čvrsto povezane s jezgrom, tako da mogu sudjelovati u kemijskim reakcijama. Elementi koji na vanjskoj razini imaju jedan do četiri elektrona u kemijskim reakcijama, u pravilu, daju elektrone, a oni koji imaju pet do sedam elektrona - prihvaćaju.
Postoje i kemijski elementi koji se zovu inertnih plinova, u kojoj vanjska energija sadrži osam elektrona - maksimalni mogući broj. Oni praktički ne ulaze u kemijske reakcije. Dakle, svaki atom ima tendenciju da "dopuni" svoj vanjski elektronski sloj na potrebne osam elektrona. Gdje da dobijete nestale? Za ostale atome.  U kemijski proces element reakcije s većom elektronegativnosti "izvodi" elektron iz elementa s manjom elektronegativnosti. Elektroničnost kemijskog elementa ovisi o broju elektrona na valencijskoj razini i o sili njihovog privlačenja jezgri. U elementu koji uzima elektrone, ukupni negativni naboj postaje veći od pozitivnog naboja jezgre, a za elektron koji odustane, to je obrnuto. Na primjer, u spoju sumporov oksid SO kisik, koji ima veliku elektronegativnost, uzima 2 elektrona od sumpora i dobiva negativni naboj, dok sumpor, koji ostaje bez dva elektrona, dobiva pozitivan naboj. U ovom slučaju stupanj oksidacije kisika jednak je stupnju oksidacije sumpora uzeta suprotnim znakom. Stupanj oksidacije je zabilježen u gornjem desnom kutu kemijski element. U našem primjeru izgleda ovako: S+2O-2.
U kemijski proces element reakcije s većom elektronegativnosti "izvodi" elektron iz elementa s manjom elektronegativnosti. Elektroničnost kemijskog elementa ovisi o broju elektrona na valencijskoj razini i o sili njihovog privlačenja jezgri. U elementu koji uzima elektrone, ukupni negativni naboj postaje veći od pozitivnog naboja jezgre, a za elektron koji odustane, to je obrnuto. Na primjer, u spoju sumporov oksid SO kisik, koji ima veliku elektronegativnost, uzima 2 elektrona od sumpora i dobiva negativni naboj, dok sumpor, koji ostaje bez dva elektrona, dobiva pozitivan naboj. U ovom slučaju stupanj oksidacije kisika jednak je stupnju oksidacije sumpora uzeta suprotnim znakom. Stupanj oksidacije je zabilježen u gornjem desnom kutu kemijski element. U našem primjeru izgleda ovako: S+2O-2.
Gornji primjer je prilično jednostavan. Zapravo, vanjski elektroni jednog atoma nikad se potpuno ne prebacuju na drugu, oni postaju "zajednički", stoga je stupanj oksidacije elemenata uvijek manji nego što je naznačeno u udžbenicima.
No kako bi se pojednostavio razumijevanje kemijskih procesa, ta činjenica je zanemarena.
 Što je elektron? Svojstva i povijest otkrivanja elektrona
Što je elektron? Svojstva i povijest otkrivanja elektrona Struktura atoma: što je neutron?
Struktura atoma: što je neutron? Koja elementarna čestica ima pozitivan naboj?
Koja elementarna čestica ima pozitivan naboj?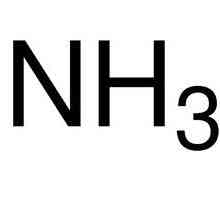 Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata Atomska jezgra. Otkrivanje tajni
Atomska jezgra. Otkrivanje tajni Definicija atoma i molekule. Definicija atoma do 1932
Definicija atoma i molekule. Definicija atoma do 1932 Što je OVR u suvremenoj kemiji?
Što je OVR u suvremenoj kemiji? Razgovarajmo o tome kako pronaći protone, neutrone i elektrone
Razgovarajmo o tome kako pronaći protone, neutrone i elektrone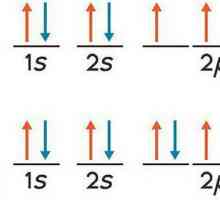 Što je elektronska konfiguracija kalija
Što je elektronska konfiguracija kalija Kako odrediti stupanj oksidacije
Kako odrediti stupanj oksidacije Kako odrediti valenciju
Kako odrediti valenciju Reakcije smanjenja oksidacije
Reakcije smanjenja oksidacije Što je električna otpornost?
Što je električna otpornost? Proton naboj je osnovna vrijednost fizike elementarnih čestica
Proton naboj je osnovna vrijednost fizike elementarnih čestica Vrste zračenja.
Vrste zračenja. Što su valentni elektroni?
Što su valentni elektroni? Rutherfordovi eksperimenti
Rutherfordovi eksperimenti Energija ionizacije atoma
Energija ionizacije atoma Što ovisi i na koji broj elektrona u atomu?
Što ovisi i na koji broj elektrona u atomu? Struktura atomske jezgre: povijest studija i suvremena obilježja
Struktura atomske jezgre: povijest studija i suvremena obilježja Što se sastoji od atoma bilo koje tvari?
Što se sastoji od atoma bilo koje tvari?
 Struktura atoma: što je neutron?
Struktura atoma: što je neutron? Koja elementarna čestica ima pozitivan naboj?
Koja elementarna čestica ima pozitivan naboj?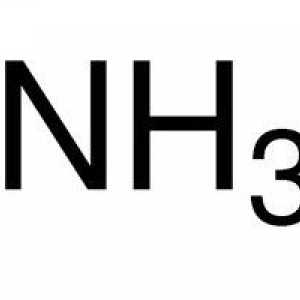 Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata Definicija atoma i molekule. Definicija atoma do 1932
Definicija atoma i molekule. Definicija atoma do 1932 Što je OVR u suvremenoj kemiji?
Što je OVR u suvremenoj kemiji? Razgovarajmo o tome kako pronaći protone, neutrone i elektrone
Razgovarajmo o tome kako pronaći protone, neutrone i elektrone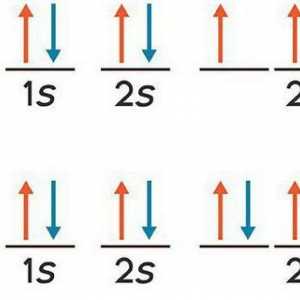 Što je elektronska konfiguracija kalija
Što je elektronska konfiguracija kalija