Esteri: kemijska svojstva i primjena
Esteri se obično nazivaju spojevima dobivenim esterifikacijom iz karboksilnih kiselina. Istodobno, OH- je zamijenjen s karboksilne skupine s alkoksi radikalom. Kao rezultat toga nastaju esteri, čija je formula općenito napisana kao R-COO-R `.
Struktura esterske skupine
Polaritet kemijskih veza u molekulama estera je analogan polarnosti veza u karboksilnim kiselinama. Glavna razlika je odsutnost pokretnog vodikovog atoma, na mjestu gdje se nalazi ugljikovodični ostatak. Istodobno, elektrofilno središte nalazi se na ugljikovom atomu esterske skupine. Ali ugljikov atom alkilne skupine povezan s njom pozitivno je polariziran.
Elektrofilnost, a time i kemijska svojstva estera, određena je strukturom ugljikovodičnog ostatka koji je zamijenio H atom u karboksilnoj skupini. Ako ugljikovodični radikal stvara konjugatski sustav s atomom kisika, onda se reaktivnost značajno povećava. To je slučaj, na primjer, u akrilnim i vinilnim esterima.
Fizička svojstva
Većina estera su tekućine ili kristalne tvari s ugodnom aromom. Temperatura njihovog ključanja je obično niža od karboksilnih kiselina sličnih u molekularnoj težini. To potvrđuje i smanjenje intermolekularnih interakcija, što se, pak, objašnjava nepostojanjem vodikovih veza između susjednih molekula.

Međutim, baš kao i kemijska svojstva estera, fizičke ovise o strukturnim značajkama molekule. Preciznije, o vrsti alkohola i karboksilnoj kiselini iz koje se formira. Na temelju toga esteri su podijeljeni u tri glavne skupine:
- Esteri voća. Oni su formirani od nižih karboksilnih kiselina i istih monohidričnih alkohola. Tekućine s karakterističnim mirisima cvjetnih voćnih mirisa.
- Voskovi. Oni su izvedeni iz više (broj ugljikovih atoma od 15 do 30) kiselina i alkohola koji imaju jednu funkcionalnu skupinu. To su plastične tvari koje se lagano omekšavaju u rukama. Glavna komponenta pčelinjeg voska je Miricil Palmitate C15H31SEA31H63, i kinez - cerijev ester cerične kiseline C25H51SEA26H53. Ne otapaju se u vodi, već su topljivi u kloroformu i benzenu.
- Masti. Izrađen je od glicerola i medija i viših karboksilnih kiselina. Životinjske masti obično su čvrste u normalnim uvjetima, ali lako se rastopaju kada se temperatura podigne (maslac, masnoća svinjetine, itd.). Za biljne masti je karakteristična tekućina (laneno ulje, maslinovo ulje, sojino ulje). Temeljna razlika u strukturi ovih dviju skupina, koja utječe na razlike u fizikalnim i kemijskim svojstvima estera, jest prisutnost ili odsutnost višestrukih veza u kiselinskom ostatku. Životinjske masti su gliceridi nezasićenih karboksilnih kiselina, a biljne masti su granične kiseline.
Kemijska svojstva
Eteri reagiraju s nukleofilima, što dovodi do supstitucije alkoksi skupine i acilacije (ili alkilacije) nukleofilnog agensa. Ako u strukturnoj formuli estera postoji alfa je atom vodika, tada je esterska kondenzacija moguća.
1. Hidroliza. Moguće je kisele i lužnate hidrolize, što je reakcija, preokrenuti esterifikaciju. U prvom slučaju, hidroliza je reverzibilna, a kiselina djeluje kao katalizator:
R-COO-R `+ H2oh <-> R-COO-H + R`-OH
Bazična hidroliza je nepovratna i obično se zove saponifikacija, a natrijeve i kalijeve soli masnih karboksilnih kiselina su sapun:
R-COO-R `+ NaOH-> R-COO-Na + R`-OH

2. Amonolizom. Nukleofilno sredstvo može biti amonijak:
R-COO-R `+ NH3 -> R-CO-NH2 + R`-OH
3. Transesterifikacijom. Ova kemijska svojstva estera također se mogu klasificirati kao načini njihova dobivanja. Pod djelovanjem alkohola u prisustvu H+ ili OH- moguće je zamijeniti ugljikovodični radikal povezan s kisikom:
R-COO-R `+ R "-OH-> R-COO-R" + R`-OH
4. Redukcija vodikom dovodi do stvaranja molekula dva različita alkohola:
R-CO-OR `+ LiAlH4 -> R-CeA-2-Ota-+ R`OH
5. Izgaranje je druga tipična reakcija za estere:
2CEta-3-COO-CEta-3 + 7D2 = 6CO2 + 6H2O
6. Hidrogenacija. Ako postoji više veza u ugljikovodičnom lancu esterske molekule, tada je moguće vezati molekule vodika, koje se javljaju u prisutnosti platine ili drugih katalizatora. Na primjer, moguće je proizvesti krute hidrogenirane masti (margarin) iz ulja.

Primjena estera
Esteri i njihovi derivati koriste se u različitim industrijama. Mnogi od njih lako otapaju razne organske spojeve, koriste se u parfumeriji i prehrambenoj industriji, za proizvodnju polimera i poliesterskih vlakana.
Etil acetat. Koristi se kao otapalo za nitrocelulozu, celulozni acetat i druge polimere, za proizvodnju i otapanje lakova. Zahvaljujući ugodnoj aromi koristi se u industriji hrane i parfema.
Butil acetat. Također se koristi kao otapalo, već već poliesterske smole.
Vinil acetat (CH3-COO-CH = CH2). Koristi se kao osnova polimera potrebnog za pripremu ljepila, lakova, sintetičkih vlakana i filmova.
Malon eter. Zbog svojih posebnih kemijskih svojstava, ovaj ester se široko koristi u kemijskoj sintezi za proizvodnju karboksilnih kiselina, heterocikličkih spojeva, aminokarboksilnih kiselina.

Ftalati. Esteri ftalne kiseline se koriste kao aditivi za plastificiranje polimerima i sintetičkim gumama, a dioktil ftalat se također koristi kao odbijajući.
Metil akrilat i metil metakrilat. Jednostavno polimeriziraju s formiranjem otpornosti na različite listove ekspozicije organskog stakla.
 Dietil eter - uporaba u medicini
Dietil eter - uporaba u medicini Fizička svojstva aldehida
Fizička svojstva aldehida Karboksilne kiseline: fizikalna svojstva. Soli karboksilnih kiselina
Karboksilne kiseline: fizikalna svojstva. Soli karboksilnih kiselina Histidin: formula, kemijske reakcije
Histidin: formula, kemijske reakcije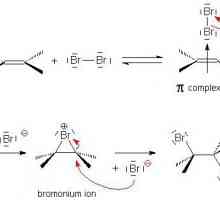 Elektrofilno dodavanje u organskoj kemiji
Elektrofilno dodavanje u organskoj kemiji Kako odrediti stupanj oksidacije
Kako odrediti stupanj oksidacije Kako odrediti valenciju
Kako odrediti valenciju Octena kiselina
Octena kiselina Opća formula aminokiselina
Opća formula aminokiselina Organski spojevi i njihova klasifikacija
Organski spojevi i njihova klasifikacija Kemijska svojstva alkohola
Kemijska svojstva alkohola Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva
Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva Benzojeva kiselina
Benzojeva kiselina Serije homologije
Serije homologije Eterima. svojstvo
Eterima. svojstvo Esteri: opća svojstva i primjena
Esteri: opća svojstva i primjena Natrij fenolat: priprema, kemijska svojstva
Natrij fenolat: priprema, kemijska svojstva Dimetil eter - moderno gorivo za dizel motore
Dimetil eter - moderno gorivo za dizel motore Adipinska kiselina. Svojstva i aplikacije
Adipinska kiselina. Svojstva i aplikacije Dikarboksilne kiseline: opis, kemijska svojstva, proizvodnja i primjena
Dikarboksilne kiseline: opis, kemijska svojstva, proizvodnja i primjena Izomerizam i nomenklatura karboksilnih kiselina, struktura i opis
Izomerizam i nomenklatura karboksilnih kiselina, struktura i opis
 Karboksilne kiseline: fizikalna svojstva. Soli karboksilnih kiselina
Karboksilne kiseline: fizikalna svojstva. Soli karboksilnih kiselina Histidin: formula, kemijske reakcije
Histidin: formula, kemijske reakcije Elektrofilno dodavanje u organskoj kemiji
Elektrofilno dodavanje u organskoj kemiji Opća formula aminokiselina
Opća formula aminokiselina