Topivost tvari: tablica. Topivost tvari u vodi
U svakodnevnom životu ljudi se rijetko susreću čiste tvari.
sadržaj
- Topivost tvari: što je to i zašto?
- Ono što je naznačeno mjerenjem topljivosti tvari
- Otapala
- Vrste rješenja po stupnju zasićenja
- Kako razlikovati zasićena otopina od nezasićenih otopina?
- Teorije interakcije komponenata otopine
- Čimbenici koji utječu na topljivost tvari
- Promjena brzine otapanja
- Zašto trebate znati topljivost krutih tvari u vodi?
- Jednadžbe kemijske reakcije
- Tablica topivosti
- Kako koristiti tablicu topljivosti tvari?
- Jednostavan primjer
- Zaključak
Otopina je homogena smjesa u kojoj se komponente ravnomjerno miješaju. Postoji nekoliko vrsta njih u smislu veličine čestica: grubo raspršeni sustavi, molekularna rješenja i koloidni sustavi, koji se često nazivaju sol. Ovaj članak se bavi molekularnim (ili istinska) rješenja. Topivost tvari u vodi je jedan od glavnih uvjeta koji utječu na formiranje spojeva.
Topivost tvari: što je to i zašto?
Da biste razumjeli ovu temu, trebate znati koja su rješenja i topivost tvari. Na jednostavnom jeziku, sposobnost tvari je povezana s drugim i oblikom homogena smjesa. Ako pristupite s znanstvenog stajališta, možete razmotriti složeniju definiciju. Topivost tvari je njihova sposobnost da s jednim ili više tvari tvore homogene (ili heterogene) sastave s dispergiranom raspodjelom komponenata. Postoji nekoliko vrsta tvari i spojeva:
- topljiv;
- slabo topljivi;
- nerješivi.

Ono što je naznačeno mjerenjem topljivosti tvari
Sadržaj tvari u zasićenoj smjesi je mjera njegove topljivosti. Kao što je gore navedeno, za sve tvari to je drugačije. Topljive - to su one koje mogu razrijediti više od 10 grama po 100 g vode. Druga je kategorija manja od 1 g pod istim uvjetima. Praktično netopivo - one u kojima mješavina prolazi manje od 0,01 g komponente. U ovom slučaju, tvar ne može prenijeti svoje molekule u vodu.
Koje je koeficijent topljivosti
Koeficijent topljivosti (k) je pokazatelj maksimalne mase tvari (g) koja se može otopiti u 100 g vode ili nekoj drugoj tvari.
otapala
Otapalo i otapalo su uključeni u ovaj proces. Prva se razlikuje po tome što se u početku nalazi u istoj agregatnoj stanju kao i konačna mješavina. U pravilu, to se uzima u većoj količini.
Međutim, mnogi znaju da voda zauzima posebno mjesto u kemiji. Postoje posebna pravila za to. Otopina u kojoj je H prisutan2O se zove voda. Kada govorimo o njima, tekućina je ekstraktant čak i kad je u manjoj količini. Primjer je 80% -tna otopina dušične kiseline u vodi. Proporcije nisu jednake ovdje, iako je udio vode manji od kiselina, tvar se pogrešno naziva 20% -tna otopina vode u dušičnoj kiselini.
Postoje mješavine u kojima nema H2O. Imat će ime bez vode. Takve elektrolitske otopine su ionski vodiči. One sadrže jednu ili mješavinu ekstrakcijskih sredstava. Njihov sastav uključuje ione i molekule. Koriste se u takvim industrijama kao što su medicina, kemikalije za kućanstvo, kozmetika i druga područja. Mogu kombinirati nekoliko potrebnih tvari s različitom topljivošću. Komponente mnogih sredstava koja se primjenjuju izvana su hidrofobne. Drugim riječima, oni ne dobro komuniciraju s vodom. U takvim smjesama, otapala mogu biti hlapljiva, nepostojiva i kombinirana. Organske tvari u prvom slučaju lako otapaju masti. Hlapljive tvari uključuju alkohole, ugljikovodike, aldehide i druge. Često su dio kućanskih kemikalija. Najčešće se koristi za pranje masti. To su masna ulja, tekući parafin, glicerin i drugi. Kombinirana - mješavina hlapivih i neugotivih, na primjer, etanol s glicerinom, glicerin s dimeksidom. Oni također mogu sadržavati vodu.
Vrste rješenja po stupnju zasićenja
Zasićena otopina je mješavina kemikalija koja sadrži maksimalnu koncentraciju jedne tvari u otapalu na određenoj temperaturi. Onda se neće razvesti. U pripremi krutine zamjetno taloženje taloga, koji je u dinamičnoj ravnoteži s njom. Ovaj pojam znači stanje koje traje u vremenu kao posljedica protoka istodobno u dva suprotna smjera (izravna i obrnuta reakcija) s istom brzinom.
Ako se supstanca pri konstantnoj temperaturi i dalje može raspasti, tada je ta otopina nezasićena. Oni su stabilni. Ali ako nastave dodavati tvar, ona će se razrijediti vodom (ili drugom tekućinom) sve dok ne postigne maksimalnu koncentraciju.
Druga vrsta je zasićena. Sadrži više otopljene tvari nego što može biti pri konstantnoj temperaturi. Zbog činjenice da su u nestabilnoj ravnoteži, kada su fizički pogođeni, kristaliziraju.
Kako razlikovati zasićena otopina od nezasićenih otopina?
Ovo je dovoljno lako. Ako je tvar čvrsto, tada se u zasićenoj otopini može vidjeti precipitat. U ovom slučaju, ekstraktant može zgušnjavati, na primjer, u zasićenom sastavu, vodi, u koju je dodan šećer.
Ali ako se promijene uvjeti, temperatura se podiže, prestat će se smatrati zasićenim jer će pri višoj temperaturi maksimalna koncentracija ove tvari biti drugačija.
Teorije interakcije komponenata otopine
Postoje tri teorije o interakciji elemenata u smjesi: fizičkom, kemijskom i modernom. Autori prve su Svante August Arrhenius i Wilhelm Friedrich Ostwald. Predložili su da se zbog difuzije čestice otapala i otopljene tvari ravnomjerno raspoređuju po volumenu smjese, ali međusobno nije bilo međudjelovanja. Suprotno je kemijska teorija, koju je iznio Dmitrij Ivanovich Mendelejev. Prema njemu, kao rezultat kemijske interakcije između njih formiraju se nestabilni spojevi konstantne ili varijabilne kompozicije, koji se nazivaju solvati.
Trenutno se koristi kombinirana teorija Vladimira Alexandrovića Kistyakovskog i Ivana Aleksejevića Kabluka. Kombinira fizičku i kemijsku. Suvremena teorija kaže da u rješenju postoje i neinterakcijske čestice tvari i proizvodi njihovih solvata interakcije, čije je postojanje dokazalo Mendeleev. U slučaju kada je ekstraktant voda, oni se nazivaju hidrati. Fenomen u kojem nastaju solvati (hidrati) naziva se solvatizacija (hidratacija). To utječe na sve fizikalnih i kemijskih procesa i mijenja svojstva molekula u smjesi. Solvata je zbog činjenice da se solvatna ljuska, koja se sastoji od blisko povezanih ekstragentnih molekula, okružuje molekulu otopljene tvari.
Čimbenici koji utječu na topljivost tvari
Kemijski sastav tvari. Pravilo "poput privlači poput" se proteže na reagense. Slične tvari u fizikalnim i kemijskim svojstvima mogu međusobno brže otopiti. Na primjer, nepolarni spojevi dobro surađuju s nepolarnim spojevima. Tvari s polarnim molekulama ili ionska struktura se uzgajaju u polarnom obliku, na primjer u vodi. Razgrađuje soli, lužine i druge komponente, a ne polarne - naprotiv. Možete dati jednostavan primjer. Za pripremu zasićene otopine šećera u vodi potrebno je više supstancija nego u slučaju soli. Kako se to treba razumjeti? Jednostavno rečeno, možete razrijediti mnogo više šećera u vodi od soli.
Temperatura. Da bi se povećala topljivost krutih tvari u tekućinama, potrebno je povećati temperaturu ekstrakcijskog sredstva (u većini slučajeva radi). Možete prikazati ovaj primjer. Ako stavite čašu natrijevog klorida (soli) u hladnu vodu, tada će taj proces potrajati dugo. Ako to učinite s vrućim medijem, otapanje će nastaviti mnogo brže. To se objašnjava činjenicom da zbog povećanja temperature povećava se kinetička energija, čija se znatna količina često troši na razbijanje veza između molekula i iona krute tvari. Međutim, kada se temperatura poveća u slučaju litija, magnezija, aluminija i alkalnih soli, njihova topivost se smanjuje.
Tlak. Ovaj faktor utječe samo na plinove. Njihova topljivost raste s povećanjem pritiska. Uostalom, količina plinova je smanjena.
Promjena brzine otapanja
Nemojte to zbuniti s topljivosti. Uostalom, promjenu ovih dvaju pokazatelja utječu različiti čimbenici.
Stupanj fragmentacije otopljene tvari. Ovaj faktor utječe na topivost krutina u tekućinama. U cijeloj (grudi) stanju, sastav se uzgaja duže nego onaj koji je razbijen u male komadiće. Dajmo primjer. Jedan dio soli će se otopiti u vodi mnogo duže od soli u obliku pijeska.
Brzina miješanja. Kao što je poznato, taj se proces može katalizirati miješanjem. Njegova brzina je također važna, jer što je više, to je brža tvar koja se otapa u tekućini.
Zašto trebate znati topljivost krutih tvari u vodi?
Prije svega, takva je shema potrebna za ispravno rješavanje kemijskih jednadžbi. U tablici topivosti nalaze se troškovi svih tvari. Moraju biti poznati za ispravno snimanje reagensa i formulaciju jednadžbe kemijske reakcije. Topivost u vodi ukazuje može li se sol ili baza disocirati. Spojevi vode koji vode struju imaju snažne elektrolite u svom sastavu. Postoji još jedna vrsta. Oni koji ne vode struju smatraju se slabim elektrolitima. U prvom slučaju, komponente su tvari potpuno ionizirane u vodi. Iako slabi elektroliti pokazuju ovaj indeks samo u maloj mjeri.
Jednadžbe kemijske reakcije
Postoji nekoliko vrsta jednadžbi: molekularni, puni ionski i kratki ionski. Zapravo, posljednja mogućnost - smanjeni oblik molekularne. Ovo je konačni odgovor. U potpunoj jednadžbi zabilježeni su reagensi i produkti reakcije. Sada je skretanje tablice topivosti tvari. Prvo, moramo provjeriti je li reakcija izvediva, tj. Ispunjava li se jedan od uvjeta za provedbu reakcije. Njihov samo 3: stvaranje vode, oslobađanje plina, oborina. Ako se ne zadovolje prva dva uvjeta, trebate provjeriti potonje. Da biste to učinili, pogledajte tablicu topivosti i saznajte ima li netopljiva sol ili baza u reakcijskim proizvodima. Ako jest, onda će to biti sediment. Zatim je potrebno napisati ionsku jednadžbu. Budući da su sve topljive soli i baze jaki elektroliti, propadat će u katione i anione. Sljedeći nevezani ioni su izrezani, a jednadžba je napisana u kratkom obliku. primjer:
- K2SO4+BaC2= BaS024darr- + 2HC1,
- 2K + 2SO4+Ba + 2Cl = BaS024darr- + 2K + 2Cl,
- Ba + SO4 = BaS024darr-.
Stoga, tablica topivosti tvari je jedan od ključnih uvjeta za rješavanje ionskih jednadžbi.
Detaljna tablica pomaže vam da saznate koliko komponente morate poduzeti kako biste pripremili zasićenu smjesu.
Tablica topivosti
Ovo je uobičajena nepotpuna tablica. Važno je ovdje navesti temperaturu vode, jer je to jedan od čimbenika koji smo gore spomenuli.

Kako koristiti tablicu topljivosti tvari?
Tablica topivosti tvari u vodi jedan je od glavnih pomagača kemičara. To pokazuje kako različite supstance i spojevi djeluju zajedno s vodom. Topivost krutina u tekućini je indikator, bez kojeg mnoge kemijske manipulacije nisu moguće.
Stol je vrlo jednostavan za korištenje. Prva linija sadrži katione (pozitivno nabijene čestice), u drugoj anionima (negativno nabijenih čestica). Većina tablica zauzima mreža s određenim simbolima u svakoj ćeliji. To su slova "P", "M", "H" i znakovi ";" i "?".
- "P" - spoj se otapa;
- "M" - slabo topljivo;
- "H" - ne otapa;
- ";" - veza ne postoji;
- "?" - nema podataka o postojanju veze.
U ovoj tablici nalazi se jedna prazna ćelija - to je voda.
Jednostavan primjer
Sada o tome kako raditi s takvim materijalom. Pretpostavimo da trebate znati da li topljiva u vodi topljivom u vodi - MgSo4 (magnezijev sulfat). Za to je potrebno pronaći stupac Mg2+ i spustite se na liniju SO42-. Na njihovom je raskrižju slovo P, pa je spoj topljiv.
zaključak
Dakle, proučavali smo problem topivosti tvari u vodi, a ne samo. Bez sumnje, ovo znanje će biti korisno u daljnjoj studiji kemije. Uostalom, topljivost tvari igra važnu ulogu. Koristan je u rješavanju obje kemijske jednadžbe i raznih problema.
 Živa (živi klorid) klorid: pripravak, svojstva i primjena
Živa (živi klorid) klorid: pripravak, svojstva i primjena Topivost željeza u vodi. Kako čistiti vodu od željeza?
Topivost željeza u vodi. Kako čistiti vodu od željeza? Glina u vodi otapa ili ne. Topivost različitih tvari
Glina u vodi otapa ili ne. Topivost različitih tvari Heterogena ravnoteža
Heterogena ravnoteža Homogene smjese: definicija pojma, sastav, primjeri
Homogene smjese: definicija pojma, sastav, primjeri Što su istinska rješenja? Svojstva i sastav
Što su istinska rješenja? Svojstva i sastav Što je topljivost?
Što je topljivost? Vrste rješenja. Vrste koncentracije otopine
Vrste rješenja. Vrste koncentracije otopine Rješenja: koncentracija, masena frakcija. Definicija, izračun i preporuke
Rješenja: koncentracija, masena frakcija. Definicija, izračun i preporuke Koje se tvari nazivaju čisto: definicija pojmova i primjera
Koje se tvari nazivaju čisto: definicija pojmova i primjera Čimbenici koji određuju topivost proteina. Fizikalno-kemijska svojstva proteina
Čimbenici koji određuju topivost proteina. Fizikalno-kemijska svojstva proteina Sustavi raspršivanja: opće karakteristike i klasifikacija
Sustavi raspršivanja: opće karakteristike i klasifikacija Jednostavne tvari
Jednostavne tvari Molekularna fizika
Molekularna fizika Fizikalna i kemijska svojstva metala
Fizikalna i kemijska svojstva metala Čimbenici koji utječu na brzinu kemijske reakcije
Čimbenici koji utječu na brzinu kemijske reakcije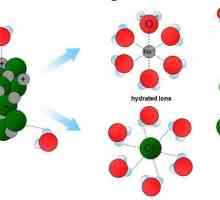 Pravo rješenje: definicija, svojstva, sastav, svojstva, primjeri
Pravo rješenje: definicija, svojstva, sastav, svojstva, primjeri Kalij permanganat: osnovna kemijska svojstva i reakcije
Kalij permanganat: osnovna kemijska svojstva i reakcije Molekularna težina: bit ovog kemijskog pokazatelja, metode određivanja
Molekularna težina: bit ovog kemijskog pokazatelja, metode određivanja Kalcijev sulfat. opis
Kalcijev sulfat. opis Koja su kolabativna svojstva rješenja?
Koja su kolabativna svojstva rješenja?



 Topivost željeza u vodi. Kako čistiti vodu od željeza?
Topivost željeza u vodi. Kako čistiti vodu od željeza? Glina u vodi otapa ili ne. Topivost različitih tvari
Glina u vodi otapa ili ne. Topivost različitih tvari Homogene smjese: definicija pojma, sastav, primjeri
Homogene smjese: definicija pojma, sastav, primjeri Što su istinska rješenja? Svojstva i sastav
Što su istinska rješenja? Svojstva i sastav Što je topljivost?
Što je topljivost? Vrste rješenja. Vrste koncentracije otopine
Vrste rješenja. Vrste koncentracije otopine Rješenja: koncentracija, masena frakcija. Definicija, izračun i preporuke
Rješenja: koncentracija, masena frakcija. Definicija, izračun i preporuke Koje se tvari nazivaju čisto: definicija pojmova i primjera
Koje se tvari nazivaju čisto: definicija pojmova i primjera Čimbenici koji određuju topivost proteina. Fizikalno-kemijska svojstva proteina
Čimbenici koji određuju topivost proteina. Fizikalno-kemijska svojstva proteina