Što su istinska rješenja? Svojstva i sastav
U prirodi se gotovo ne pojavljuju čiste tvari.
sadržaj

Značajke pravih rješenja
Prava rješenja su vrsta disperznih sustava koji imaju veliku čvrstoću između disperzijskog medija i disperzne faze.
Svaka kemikalija može proizvesti kristale različitih veličina. U svakom slučaju, imat će istu unutarnju strukturu: ionsku ili molekularnu kristalnu rešetku.
raspuštanje
Tijekom otapanja žitarica natrijevog klorida i šećera u vodi nastaje ionska i molekularna otopina. Ovisno o stupnju fragmentacije, tvar može biti u obliku:
- vidljive makroskopne čestice čija je veličina veća od 0,2 mm;
- mikroskopske čestice koje imaju veličinu manju od 0,2 mm, mogu se uhvatiti samo pomoću mikroskopa.
Istinska i koloidna rješenja se razlikuju po veličini čestica otopljene tvari. Nevidljivi kristali se nazivaju koloidnim česticama u mikroskopu, a dobivena se stanje naziva koloidna otopina.

Faza otopine
U mnogim slučajevima, prava rješenja su razbacani (raspršeni) sustavi homogenog oblika. One sadrže kontinuiranu kontinuiranu fazu - disperzijski medij, i zdrobljene čestice određenog oblika i veličine (disperzna faza). Koja je razlika između koloidnih rješenja i pravih sustava?
Glavna je razlika u veličini čestice. Koloidni disperziranog sustavi se smatraju heterogenim, jer je nemoguće otkriti sučelje između faza u svjetlosnom mikroskopu.
Prava rješenja su opcija kada se u okolišu supstancija predstavlja kao ioni ili molekule. Oni se odnose na jednofazne homogene otopine.
Kao preduvjet za stvaranje disperznih sustava uzima se u obzir međusobno otapanje disperzijskog sredstva i disperzivne tvari. Na primjer, natrij klorid i saharoza su netopljivi u benzenu i kerozinu, pa se u takvom otapalu neće formirati koloidna otopina.

Razvrstavanje raspršenih sustava
Kako su raspršeni sustavi podijeljeni? istinski rješenja, koloidna sustavi se razlikuju u nekoliko parametara.
Postoji razdioba raspršenih sustava preko agregatnog stanja medija i raspršene faze, formiranja ili odsutnosti interakcije između njih.
karakteristike
Postoje određene kvantitativne karakteristike disperzije materije. Prije svega se razlikuje stupanj raspršivanja. Ta je vrijednost inverzna veličina čestica. Ono obilježava broj čestica koje se mogu nalaziti u nizu na udaljenosti od jednog centimetra.
U slučaju kada sve čestice imaju iste dimenzije, formira se monodisperzni sustav. S neidentificiranim česticama disperzne faze nastaje polidisperzni sustav.
Uz povećanje disperzije materije, procesi koji se javljaju na površini interfaze povećavaju. Na primjer, povećava se specifična površina disperzne faze, povećavaju se fizikalno-kemijski učinci medija na sučelju između dvije faze.

Varijante raspršenih sustava
Ovisno o fazi u kojoj će se otopina otopiti, izolirane su različite varijante raspršenih sustava.
Aerosoli su raspršeni sustavi u kojima je dispergirani medij predstavljen u plinovitom obliku. Mistovi su aerosoli koji imaju tekuću disperziranu fazu. Dim i prašina čine krutu disperziranu fazu.
Pjene su disperzija u tekućini plinovite tvari. Tekućine u pjenama degeneriraju se na filmove koji odvajaju plinovite mjehuriće.
Emulzije se nazivaju disperzni sustavi, gdje se jedna tekućina distribuira u volumenu od strane drugog, a da se ne otopi u njemu.
Suspenzije ili suspenzije su nisko disperzijski sustavi u kojima su čvrste čestice u tekućini. Koloidne otopine ili solovi s vodenim disperziranim sustavom nazivaju se hidrosoli.
Ovisno o prisutnosti (odsutnosti) između čestica disperzne faze, izolirani su slobodno dispergirani ili kohezivni raspršeni sustavi. Prva skupina uključuje lizozole, aerosole, emulzije, suspenzije. U takvim sustavima nema kontakata između čestica i disperzne faze. Oni se slobodno kreću u otopini pod utjecajem gravitacije.
Koherentni sustavi nastaju u slučaju kontakta čestica s disperziranom fazom, zbog čega se strukture formiraju u obliku rešetke ili okvira. Takvi koloidni sustavi nazivaju se gelovi.
Postupak geliranja (geliranje) je pretvorba soli u gel na osnovi smanjenja stabilnosti inicijalnog sol. Primjeri kohezivnih raspršenih sustava su suspenzije, emulzije, prašci, pjene. One također uključuju tlo nastale tijekom interakcije organskih (humusnih) tvari i minerala tla.
Kapilarne disperzne sustave karakterizira kontinuirana masa tvari koja prodire u kapilare i pore. Oni smatraju tkanine, različite membrane, drvo, karton, papir.
Istinska rješenja su homogeni sustavi koji se sastoje od dvije komponente. Oni mogu postojati u različitim otapalima u agregatnom stanju. Otapalo se smatra supstancom preuzetim u suvišku. Komponenta koja se uzima u nedovoljnim količinama smatra se otopljenom supstancom.

Značajke rješenja
Čvrste legure su također rješenja u kojima različiti metali djeluju kao dispergirani mediji i komponente. S praktičnog stajališta od posebnog interesa su tekuće smjese u kojima tekućina djeluje kao otapalo.
Od mnogih anorganskih otapala, voda je od posebnog interesa. Praktički se uvijek stvara istinska otopina kada se čestice otopljene tvari pomiješaju s vodom.
Od organskih spojeva, slijedeća otapala su izvrsna otapala: etanol, metanol, benzen, ugljik tetraklorid, aceton. Zbog kaotičnog gibanja molekula ili iona otopljene komponente dolazi do djelomičnog prijelaza na otopinu, stvaranje novog homogenog sustava.
Tvari se razlikuju po svojoj sposobnosti da oblikuju rješenja. Neki se mogu miješati jedni s drugima u neograničenim količinama. Primjer je otapanje u vodi kristala stolne soli.
Bit procesa otapanja s gledišta molekularno-kinetičke teorije je da nakon uvođenja kristala natrijevog klorida u otapalo disocira u natrij katione i klor anione. Napunjene čestice vibriraju, sudari s česticama samog otapala dovode do prijelaza iona u otapalo (vezanje). Postupno, druge čestice su spojene na proces, površinski sloj je uništen, kristal sol otopi u vodi. Difuzija omogućuje distribuciju čestica tvari duž volumena otapala.

Vrste istinskih rješenja
Pravo rješenje je sustav koji je podijeljen u nekoliko tipova. Postoji klasifikacija takvih sustava za vodu i nevodenu za vrstu otapala. Također se klasificiraju prema varijanti otopljene tvari za lužine, kiseline, soli.
Postoje različite vrste istinitih rješenja s obzirom na električnu struju: nonelektroliti, elektroliti. Ovisno o koncentraciji otopljene tvari, mogu se razrijediti ili koncentrirati.
Istinska rješenja niskomolekularnih tvari iz termodinamičkog gledišta podijeljena su u stvarnu i idealnu.
Takva rješenja mogu biti ionski raspršena, kao i sustavi molekularno disperzni.

Zasićenje rješenja
Ovisno o tome koliko čestica prelazi u otopinu, postoje zasićene, nezasićene, zasićene otopine. Otopina je tekući ili kruti, homogeni sustav koji se sastoji od nekoliko komponenti. U takvom sustavu nužno je otapalo, kao i otopljena supstanca. S otapanjem nekih tvari, topline se oslobađa.
Sličan proces potvrđuje teoriju rješenja, prema kojoj se otapanje smatra fizikalno-kemijskim procesom. Postoji podjelu procesa topivosti u tri skupine. Prva se sastoji od onih tvari koje se mogu otapati u količini od 10 g po 100 g otapala, oni se nazivaju dobro topivi.
Tvari se smatraju slabo topljivima ako se manje od 10 g otopi u 100 g komponente, drugi se zovu netopljivi.
zaključak
Sustavi koji se sastoje od različitih u agregatnom stanju, veličine čestica, nužni su za normalnu ljudsku aktivnost. Istinska, koloidna rješenja koja su gore diskutirana koriste se za izradu lijekova, stvaranje prehrambenih proizvoda. Imajući ideju o koncentraciji otopljene tvari, možete samostalno pripremiti neophodno rješenje, na primjer, etilni alkohol ili octenu kiselinu, za različite svrhe u svakodnevnom životu. Ovisno o stanju u kojoj je topiva tvar i otapalo u agregatnom stanju, rezultirajući sustavi imaju određena fizikalna i kemijska svojstva.
 Brownian motion: opće informacije.
Brownian motion: opće informacije. Čiste supstance: primjeri. Priprema čistih tvari
Čiste supstance: primjeri. Priprema čistih tvari Kako rastu kristali iz soli i drugih tvari?
Kako rastu kristali iz soli i drugih tvari? Glina u vodi otapa ili ne. Topivost različitih tvari
Glina u vodi otapa ili ne. Topivost različitih tvari Heterogena ravnoteža
Heterogena ravnoteža Homogene smjese: definicija pojma, sastav, primjeri
Homogene smjese: definicija pojma, sastav, primjeri Organska i fizkolloidnaya kemija: opis, zadaci i značajke
Organska i fizkolloidnaya kemija: opis, zadaci i značajke Vrste rješenja. Vrste koncentracije otopine
Vrste rješenja. Vrste koncentracije otopine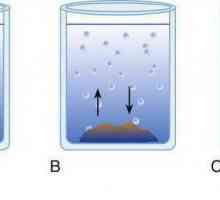 Rješenja: koncentracija, masena frakcija. Definicija, izračun i preporuke
Rješenja: koncentracija, masena frakcija. Definicija, izračun i preporuke Topivost tvari: tablica. Topivost tvari u vodi
Topivost tvari: tablica. Topivost tvari u vodi Koje se tvari nazivaju čisto: definicija pojmova i primjera
Koje se tvari nazivaju čisto: definicija pojmova i primjera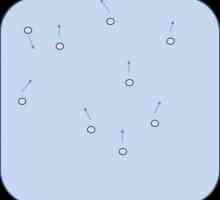 Što je raspršena faza?
Što je raspršena faza? Sustavi raspršivanja: opće karakteristike i klasifikacija
Sustavi raspršivanja: opće karakteristike i klasifikacija Sintetički deterdženti
Sintetički deterdženti Struktura materije
Struktura materije Molekularna fizika
Molekularna fizika Ionska kristalna rešetka
Ionska kristalna rešetka Kolloidna čestica: definicija, svojstva, vrste i svojstva
Kolloidna čestica: definicija, svojstva, vrste i svojstva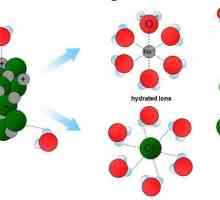 Pravo rješenje: definicija, svojstva, sastav, svojstva, primjeri
Pravo rješenje: definicija, svojstva, sastav, svojstva, primjeri Koloidna rješenja - nova riječ u medicini
Koloidna rješenja - nova riječ u medicini Rješenja elektrolita
Rješenja elektrolita
 Čiste supstance: primjeri. Priprema čistih tvari
Čiste supstance: primjeri. Priprema čistih tvari Kako rastu kristali iz soli i drugih tvari?
Kako rastu kristali iz soli i drugih tvari? Glina u vodi otapa ili ne. Topivost različitih tvari
Glina u vodi otapa ili ne. Topivost različitih tvari Homogene smjese: definicija pojma, sastav, primjeri
Homogene smjese: definicija pojma, sastav, primjeri Organska i fizkolloidnaya kemija: opis, zadaci i značajke
Organska i fizkolloidnaya kemija: opis, zadaci i značajke Vrste rješenja. Vrste koncentracije otopine
Vrste rješenja. Vrste koncentracije otopine Rješenja: koncentracija, masena frakcija. Definicija, izračun i preporuke
Rješenja: koncentracija, masena frakcija. Definicija, izračun i preporuke Topivost tvari: tablica. Topivost tvari u vodi
Topivost tvari: tablica. Topivost tvari u vodi Koje se tvari nazivaju čisto: definicija pojmova i primjera
Koje se tvari nazivaju čisto: definicija pojmova i primjera