Helium: svojstva, svojstva, primjena
Helium je inertni plin 18. skupine periodičnog stola. Ovo je drugi najlakši element nakon vodika. Helium je plin bez boje, mirisa i okusa koji postaje tekući na temperaturi od -268.9 ° C. Točka vrenja i točka smrzavanja niži su od bilo koje druge poznate supstance. To je jedini element koji se ne skrutne nakon hlađenja pri normalnom atmosferskom tlaku. Kako bi se helij prolazio u čvrstom stanju, potrebne su 25 atmosfere na temperaturi od 1 K.
sadržaj
Povijest otkrića
Helij je pronađena u atmosferi plina koji okružuje Sunce, francuski astronom Pierre Zhansenom da je u 1868. za vrijeme pomrčine je pronašao svijetle žute linije u spektru sunčevog kromosfera. Izvorno se pretpostavlja da je ova linija predstavljala element natrija. Iste je godine engleski astronom Joseph Norman Lockyer promatrao žutu liniju u sunčevom spektru koji nije odgovarala poznatom natrijevom D1 i D2, i tako je nazvao linijom D3. Lockyer je došao do zaključka da je to uzrokovano tvari na Suncu, nepoznato na Zemlji. On i kemičar Edward Frankland u ime elementa koriste grčki naziv sunca "helios".
Godine 1895. britanski kemičar Sir William Ramsay dokazao je postojanje helija na Zemlji. Dobio je uzorak uranifernog minerala claveita, a nakon proučavanja plinova nastalih tijekom zagrijavanja, otkrio je da svijetlo žuta linija u spektru podudara se s linijom D3, promatrana u sunčevom spektru. Stoga je novi element napokon uspostavljen. Godine 1903. Ramzi i Frederic Sodd utvrdili su da je helij proizvod spontanog propadanja radioaktivnih tvari.

Distribucija u prirodi
Masa helija je oko 23% ukupne mase svemira, a element je drugi najprostorniji u svemiru. Koncentriran je u zvijezdama, gdje nastaje iz vodika kao rezultat termonuklearne fuzije. Iako je helij u atmosferi je u koncentraciji od 1 dijela na 200-og. (5 ppm), a nalazi se u malim količinama radioaktivnih minerala, meteorita žlijezde, kao i mineralnih izvora, velike količine elementa nalaze u SAD-u (pogotovo u Teksasu, Novom Meksiku, Kansasu, Oklahomi, Arizoni i Utahu) kao komponentu (do 7,6%) prirodnog plina. Njegove male rezerve otkrivene su u Australiji, Alžiru, Poljskoj, Kataru i Rusiji. U zemljinoj kori, koncentracija helija je samo oko 8 dijelova na milijardu.
izotopi
Jezgra svakog atoma helija sadrži dva protona, ali, kao i drugi elementi, ima izotope. One sadrže jedan do šest neutrona, pa su njihovi masovni brojevi u rasponu od tri do osam. Stabilni su od tih elemenata u kojima se masa helija određuje atomskim brojevima 3 (3On) i 4 (4On). Svi ostali su radioaktivni i vrlo brzo se razgrađuju u druge tvari. Zemlja helija nije izvorni konstitutivni dio planeta, nastao je kao rezultat radioaktivnog raspadanja. Alfa čestice koje emitiraju jezgre teških radioaktivnih tvari su jezgre izotopa 4On je. Helium se ne nakuplja u velikim količinama u atmosferi, jer gravitacija Zemlje nije dovoljna da spriječi njezino postupno propuštanje u svemir. pjesme 3Objašnjen je na Zemlji negativnim beta-raspadom rijetkog elementa vodika-3 (tritija). 4On je najčešći stabilni izotop: omjer broja atoma 4On je 3On je oko 700 tisuća do 1 u atmosferi i oko 7 milijuna do 1 u nekim mineralima koji sadrže helij.

Fizička svojstva helija
Točka vrenja i talište ovog elementa su najniža. Iz tog razloga, helij postoji kao plin, osim iznimnih uvjeta. Plinoviti On se u vodi otapa manje od bilo kojeg drugog plina, a brzina difuzije kroz krutinu je tri puta veća od one zraka. Indeks refrakcije najbliži je 1.
Toplinska provodljivost helija je druga samo na toplinskoj vodljivosti vodika, a njegova specifična toplina je neuobičajeno visoka. Pri običnim temperaturama tijekom ekspanzije zagrijava, a ispod 40 K se hladi. Stoga, za T<40 K, helij se može pretvoriti u tekućinu ekspanzijom.
Element je dielektrik ako nije u ioniziranom stanju. Poput ostalih plemenitih plinova, helij ima razinu metastabilne energije koja mu dopušta da ostane ionizirana u električnom pražnjenju kada napon ostane ispod ionizacijskog potencijala.
Helium-4 je jedinstven po tome što ima dva tekuća oblika. Uobičajena se naziva helij I i postoji na temperaturama od točke ključanja od 4,21 K (-268,9 ° C) do oko 2,18 K (-271 ° C). Ispod 2,18 K toplinske vodljivosti 4Postaje 1000 puta više od bakra. Taj se oblik naziva helij II, kako bi se razlikovao od običnih. Ima superfluidnost: viskoznost je toliko niska da se ne može mjeriti. Helium II ulazi u tanki film na površini bilo koje tvari koju dotakne, a ovaj film teče bez trenja, čak i protiv gravitacije.
Manje bogat helij-3 tvori tri različite tekuće faze, od kojih su dva superfluida. Superfluidnost u 4Otkrio ga je sovjetski fizičar Petr Leonidovich Kapitza sredinom tridesetih godina prošlog stoljeća, a isti fenomen u 3Prvo je promatrao Douglas D. Osherov, David M. Lee i Robert S. Richardson iz Sjedinjenih Država 1972. godine.
Tekuća smjesa dva alfa-3 i -4 izotopa pri temperaturama ispod 0,8 K (-272,4 ° C) je podijeljena u dva sloja - u biti čist 3On i mješavine 4On je s 6% helijem-3. raspuštanje 3On je u 4Uz to je i učinak hlađenja koji se koristi za dizajn kriostata u kojima temperatura helija pada ispod 0.01 K (-273.14 ° C) i održava se nekoliko dana.

veze
U normalnim uvjetima, helij je kemijski inertan. U ekstremnim slučajevima moguće je stvoriti priključke elementa koji, pod normalnim uvjetima temperature i tlaka, nisu stabilni. Na primjer, mogu formirati spojeve helij s jodom, volframa, fluor, fosfora i sumpora, kada je podvrgnuta električnog pražnjenja sjaj ili bombardiranja elektronima u plazmi. Tako, HeNe, HgHe10, whe2 i molekularnih iona2+, Nemojte2++, Heh+ i HeD+. Ova je tehnika također omogućila dobivanje neutralnih molekula2 i HgHe.
plazma
U Svemiru se ionizirajući helij pretežno distribuira, čija svojstva se značajno razlikuju od molekularne. Elektroni i protoni nisu spojeni i imaju vrlo visoku električnu provodljivost, čak iu djelomično ioniziranom stanju. Napunjene čestice jako utječu magnetska i električna polja. Na primjer, u solarnom vjetru s alfa česticama interakciju s ioniziranog vodika magnetosfere zemlji, uzrokujući aurora borealis.

Otkrivanje depozita u SAD-u
Nakon bušenja bušotine 1903. godine u Dexteru, Kansas, dobivena je nezapaljiva plina. U početku nije bilo poznato da je sadržavao helij. Koji plin je pronađen, identificiran stanje Erasmus Haworth geolog, koji je prikupio svoje uzorke i University of Kansas preko kemičara Cady Hamilton i David McFarland otkrili da sadrži 72% dušika, 15% metana, 1% vodika i 12% nije identificiran. Nakon daljnje analize, istraživači su otkrili da je 1,84% uzorka helij. Tako je saznao da je ovaj kemijski element prisutan u ogromnim količinama u utrobi Velikih nizina, odakle se može izvući iz prirodnog plina.
Industrijska proizvodnja
Time su Sjedinjene Države postale svjetski lider u proizvodnji helija. Na prijedlog Sir Richard Threlfall, američka mornarica financira tri male pilot postrojenja za proizvodnju ove supstance tijekom Prvog svjetskog rata kako bi se osigurala baraž balone lagani ne-zapaljive podizanje plin. Za ovaj program ukupno 5700 m3 92 posto, iako je prije toga dobiveno samo manje od 100 litara plina. Dio tog zapisa koristi se u prvom svjetskom zrakoplovu za helij Američka mornarica C-7, koji je napravio svoj prvi let s Hampton Roads (Virginia) u polju Bolling (Washington, DC) 7. prosinca 1921.
Iako je proces niskotemperaturnog ukapljavanja plina u to vrijeme bio nedovoljno razvijen da bi se dokazao značajnim tijekom Prvog svjetskog rata, proizvodnja se nastavila. Helium se uglavnom koristi kao plin za podizanje u zrakoplovu. Potražnja za njom rasla je tijekom Drugog svjetskog rata, kada je počela koristiti za zaštićeni zavarivanje. Element je također bio važan u projektu stvaranja atomske bombe "Manhattan".

Nacionalni rezervat SAD-a
Godine 1925., vlada SAD-a stvorila je Nacionalni rezervat helija u Amarilju u Teksasu kako bi osigurao vojne zračne brodove tijekom rata i komercijalnih zrakoplova u miru. Korištenje plina pala nakon Drugog Svijeta, ali je dionica povećana je u 1950. kako bi, između ostalog, opskrbljuje kao rashladno sredstvo koristi u proizvodnji kisika vodika potisnog plina tijekom svemirske utrke i hladnog rata. Korištenje helija u SAD-u 1965. bila je osam puta veća potrošnja u vrijeme rata.
Nakon donošenja zakona o heliju 1960. godine, Mountain Bureau sklopio je 5 privatnih poduzeća za izdvajanje elementa iz prirodnog plina. Ovaj program je izgrađen 425-km cjevovoda za povezivanje ove biljke s državnom djelomično iscrpljena plinskog polja u blizini Amarillo, Texas. Smjesa helij-dušika je pumpana u podzemni spremnik i ostala tamo dok nije bila potrebna.
Do 1995. godine prikupljeno je zalihe od 1 milijarde kubičnih metara, a Nacionalni rezervat iznosio je 1,4 milijarde dolara, što je potaknulo američki Kongres na odstupanje od 1996. godine. Nakon usvajanja Zakona o privatizaciji helija 1996. godine, Ministarstvo prirodnih resursa je 2005. godine likvidiralo depozitar.

Čistoća i količine proizvodnje
Helium, proizveden prije 1945. godine, imao je čistoću od oko 98%, a preostalih 2% čine dušik, što je dovoljno za dirigible. Godine 1945. proizvedena je mala količina plina od 99,9% za uporabu u elektrolučnom zavarivanju. Do 1949. godine čistoća rezultirajućeg elementa dosegla je 99,995%.
Tijekom godina, Sjedinjene Države su proizveli više od 90% svjetskog komercijalnog helija. Od 2004. godine proizveden je godišnje na 140 milijuna m3, Od kojih 85% pada na SAD, 10% je proizvedeno u Alžiru, a ostalo - u Rusiji i Poljskoj. Glavni izvori helija u svijetu su plinsko polje Teksasa, Oklahome i Kansasa.
Postupak dobivanja
Helium (čistoća 98,2%) se iz prirodnog plina izdvaja ukapljivanjem ostalih komponenata pri niskim temperaturama i pri visokim pritiscima. Adsorpcija ostalih plinova ohlađenim aktivnim ugljikom omogućuje postizanje čistoće od 99,995%. Mala količina helija nastaje pri ukapljavanju zraka na velikom mjerilu. Od 900 tona zraka možete dobiti oko 3,17 kubnih metara. m plina.

Područja primjene
Plemeniti plin je pronašao primjenu na različitim poljima.
- Helij, koja svojstva omogućuju da se dobije vrlo niske temperature, koja se koristi kao sredstvo za hlađenje u LHC, MRI uređaja supravodljivim magnetom i nuklearnom magnetskom rezonancom, spektrometrima magnetskog satelitske opreme, kao i za ukapljivanje kisik i vodik u projektila „Apollo”.
- Kao inertni plin za zavarivanje aluminija i drugih metala, u proizvodnji optičkih vlakana i poluvodiča.
- .. Za stvaranje tlaka u spremnicima za gorivo motora raketa, osobito onih koji djeluju na tekući vodik, t samo plina helija čuva svoje stanje agregacije kada vodik ostane tekuća);
- On-Ne laseri plina Koristi se za skeniranje barkodova kod blagajnika u supermarketima.
- Helium-ionski mikroskop vam omogućuje da dobijete bolje slike od elektronskih.
- Zbog visoke propusnosti plemenitog plina koristi se za testiranje propuštanja, na primjer u auto klima uređaja, kao i brzo punjenje zračni jastuk na sudar.
- Niska gustoća dopušta popunjavanje dekorativnih sfera helijem. Inertni plin zamijenio je eksplozivni vodik u zračnim brodovima i balonima. Na primjer, u meteorologiji, helijske kuglice se koriste za dizanje mjernih instrumenata.
- U kriogenskoj tehnologiji služi kao rashladno sredstvo, jer je temperatura ovog kemijskog elementa u tekućem stanju najniža moguća.
- Helij, koja svojstva se pružaju niska topljivost u vodi i reaktivnost (i krv), u smjesi s kisikom je našao primjenu u respiratornim formulacija za ronjenje i drži udubine rad.
- Analiziraju se meteoriti i stijene za sadržaj ovog elementa kako bi se utvrdilo njihovo doba.
Helium: svojstva elementa
Osnovna fizička svojstva On su kako slijedi:
- Atomski broj: 2.
- Relativna masa atoma helija: 4,0026.
- Talište: br.
- Točka vrelišta: -268.9 ° C.
- Gustoća (1 atm, 0 ° C): 0.1785 g / p.
- Oksidacijska stanja: 0.
 Najteži plin. Radioaktivni plin radon: svojstva, svojstva, poluživot
Najteži plin. Radioaktivni plin radon: svojstva, svojstva, poluživot Ozon je plin plave boje. Svojstva i primjena plina. Ozon u atmosferi
Ozon je plin plave boje. Svojstva i primjena plina. Ozon u atmosferi Atmosfera i kemijski sastav Sunca: opis i struktura
Atmosfera i kemijski sastav Sunca: opis i struktura Što znamo o ugljičnom dioksidu?
Što znamo o ugljičnom dioksidu? Ozon (kemijski element): svojstva, formula, oznaka
Ozon (kemijski element): svojstva, formula, oznaka Dužina je ta stvar? Vrste i svojstva dušika
Dužina je ta stvar? Vrste i svojstva dušika Što je kisik? Kisik spojevi
Što je kisik? Kisik spojevi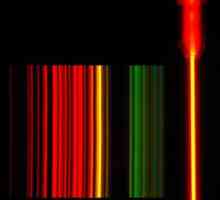 Što je neon? Kemijska i fizikalna svojstva neuna, primjena
Što je neon? Kemijska i fizikalna svojstva neuna, primjena Argon je poseban element periodičnog stola
Argon je poseban element periodičnog stola Sastav prirodnog plina
Sastav prirodnog plina Najlakši plinovi. Značajke vodika, kisika i dušika
Najlakši plinovi. Značajke vodika, kisika i dušika Eksplozivna granica prirodnog plina. Fizička svojstva plina
Eksplozivna granica prirodnog plina. Fizička svojstva plina Tekući vodik: svojstva i primjene
Tekući vodik: svojstva i primjene Tekući helij: svojstva i svojstva tvari
Tekući helij: svojstva i svojstva tvari Agregatno stanje materije
Agregatno stanje materije Inertni plinovi su opći koncepti, svojstva i primjene
Inertni plinovi su opći koncepti, svojstva i primjene Gustoća dušika
Gustoća dušika Relativna gustoća plina
Relativna gustoća plina Vodikov atom je najjednostavniji element
Vodikov atom je najjednostavniji element Metalni vodik
Metalni vodik Tekući kisik. Opće informacije
Tekući kisik. Opće informacije
 Ozon je plin plave boje. Svojstva i primjena plina. Ozon u atmosferi
Ozon je plin plave boje. Svojstva i primjena plina. Ozon u atmosferi Atmosfera i kemijski sastav Sunca: opis i struktura
Atmosfera i kemijski sastav Sunca: opis i struktura Što znamo o ugljičnom dioksidu?
Što znamo o ugljičnom dioksidu? Ozon (kemijski element): svojstva, formula, oznaka
Ozon (kemijski element): svojstva, formula, oznaka Dužina je ta stvar? Vrste i svojstva dušika
Dužina je ta stvar? Vrste i svojstva dušika Što je kisik? Kisik spojevi
Što je kisik? Kisik spojevi Što je neon? Kemijska i fizikalna svojstva neuna, primjena
Što je neon? Kemijska i fizikalna svojstva neuna, primjena Argon je poseban element periodičnog stola
Argon je poseban element periodičnog stola Najlakši plinovi. Značajke vodika, kisika i dušika
Najlakši plinovi. Značajke vodika, kisika i dušika