Аммиак – это антипод и аналог воды?
Запах данного газа известен каждому – его сразу можно почувствовать, если открыть баночку с нашатырным спиртом. Кое-что о его свойствах нам рассказывали еще в школе. Также известно и то, что он является одним из ключевых продуктов химической промышленности: именно в него легче всего превратить азот, который так не любит вступать в химические реакции. Аммиак – это первый пункт, от которого начинается производство многих азотосодержащих соединений: различных нитритов и нитратов, взрывчатых веществ
sadržaj
Краткая справка
 Название данного вещества происходит от греческого «hals ammoniakos», что в переводе означает нашатырь. Молекула аммиака представляет собой некое подобие пирамиды, в вершине которой находится атом азота, а в основании – три атома водорода. Формула данного соединения - NH3. В нормальных условиях аммиак – это бесцветный газ с удушливым резким запахом. Плотность его при -33,35 °С (температура кипения) равна 0,681 г/см3. А плавится это вещество при -77,7 °С. Молярная масса аммиака равна 17 грамм на моль. Давление в 0,9 Мпа заставляет при комнатной температуре аммиак сжиматься. Получают его в промышленности под давлением с помощью каталитического синтеза из водорода и кислорода. Жидкий аммиак – это высококонцентрированное удобрение, хладагент. С этим веществом следует проявлять осторожность, так как оно токсично и взрывоопасно.
Название данного вещества происходит от греческого «hals ammoniakos», что в переводе означает нашатырь. Молекула аммиака представляет собой некое подобие пирамиды, в вершине которой находится атом азота, а в основании – три атома водорода. Формула данного соединения - NH3. В нормальных условиях аммиак – это бесцветный газ с удушливым резким запахом. Плотность его при -33,35 °С (температура кипения) равна 0,681 г/см3. А плавится это вещество при -77,7 °С. Молярная масса аммиака равна 17 грамм на моль. Давление в 0,9 Мпа заставляет при комнатной температуре аммиак сжиматься. Получают его в промышленности под давлением с помощью каталитического синтеза из водорода и кислорода. Жидкий аммиак – это высококонцентрированное удобрение, хладагент. С этим веществом следует проявлять осторожность, так как оно токсично и взрывоопасно.
Любопытные факты
Жидкий аммиак обладает довольно необычными свойствами. Внешне он напоминает простую воду. Подобно Н2О, он прекрасно растворяет многие органические и неорганические соединения. Большинство солей в нем диссоциируют при растворении на ионы. В то же время химические реакции, в отличии от воды, в нем происходят совершенно по-другому.
ZnCl2 | BaCl2 | KCl | NaCl | KI | Ba(NO3)2 | AgI | ||
Растворимость при 20˚С в расчете на 100 г растворителя | аммиак | 0 | 0 | 0.04 | 3 | 182 | 97 | 207 |
вода | 367 | 36 | 34 | 36 | 144 | 9 | 0 |
Данные в этой таблице приводят к мысли о том, что жидкий аммиак – это уникальная среда для проведения некоторых обменных реакций, которые в водных растворах практически неосуществимы.  Например:
Например:
2AgCl + Ba(NO3)2 = 2AgNO3 + BaCl2.
Поскольку NH3 является сильным акцептором протонов, уксусная кислота, несмотря на то, что она считается слабой, продиссоциирует полностью, подобно тому, как это делают сильные кислоты. Наибольший интерес представляют растворы в нашатырном спирте щелочных металлов. Еще в 1864 году химики обратили внимание, что если дать им какое-то время, аммиак испарится, а в осадке окажется чистый металл. Практически то же самое происходит и с водными растворами солей. Отличие состоит в том, что щелочные металлы, хоть и в небольшом количестве, но все же вступают в реакцию с аммиаком, в результате чего образуются солеобразные амиды:
2Na+ 2NH3 = 2NaNH2 + H2.
Последние представляют собой вполне устойчивые вещества, но при соприкосновении с водой сразу же распадаются:
NaNH2 + H2O= NH3 + NaOH.
 При исследовании свойств жидкого аммиака химики обратили внимание, что при растворении металла в нем, объем раствора становится больше. Причем, плотность его при этом снижается. В этом заключается еще одно отличие рассматриваемого растворителя от обычной воды. Сложно поверить, но концентрированный и разбавленный раствор любого щелочного металла в жидком аммиаке не смешиваются между собой, несмотря на то, что металл в обоих из них тот же самый! Благодаря экспериментам постоянно обнаруживаются новые удивительные факты. Так, оказалось, что замороженный в жидком аммиаке раствор натрия имеет очень малое сопротивление, а значит, NH3 можно использовать для получения сверхпроводящей системы. Неудивительно, что этот газ и его растворы до сих пор интересуют умы как физиков, так и химиков.
При исследовании свойств жидкого аммиака химики обратили внимание, что при растворении металла в нем, объем раствора становится больше. Причем, плотность его при этом снижается. В этом заключается еще одно отличие рассматриваемого растворителя от обычной воды. Сложно поверить, но концентрированный и разбавленный раствор любого щелочного металла в жидком аммиаке не смешиваются между собой, несмотря на то, что металл в обоих из них тот же самый! Благодаря экспериментам постоянно обнаруживаются новые удивительные факты. Так, оказалось, что замороженный в жидком аммиаке раствор натрия имеет очень малое сопротивление, а значит, NH3 можно использовать для получения сверхпроводящей системы. Неудивительно, что этот газ и его растворы до сих пор интересуют умы как физиков, так и химиков.
 Селитра – что это такое?
Селитра – что это такое? Оксид азота (I, II, III, IV, V): свойства, получение, применение
Оксид азота (I, II, III, IV, V): свойства, получение, применение Уникальные физические и химические свойства воды
Уникальные физические и химические свойства воды Чилийская селитра: формула и свойства. Химическая формула селитры
Чилийская селитра: формула и свойства. Химическая формула селитры Калиевая селитра и её применение
Калиевая селитра и её применение Серная кислота и её использование
Серная кислота и её использование Оксид калия. Свойства, добыча, применение
Оксид калия. Свойства, добыча, применение Аммиак. Химические свойства, физические характеристики. Применение и получение
Аммиак. Химические свойства, физические характеристики. Применение и получение Серная кислота. Формула, свойства, получение и применение
Серная кислота. Формула, свойства, получение и применение Раствор аммиака – получение и применение
Раствор аммиака – получение и применение Получение аммиака в лабораторных и промышленных масштабах
Получение аммиака в лабораторных и промышленных масштабах Соединения азота. Свойства азота
Соединения азота. Свойства азота Криптон - химический элемент. Формула криптона
Криптон - химический элемент. Формула криптона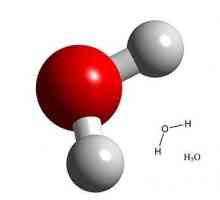 Какова роль воды в клетке человека
Какова роль воды в клетке человека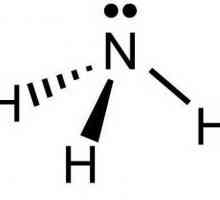 Что такое аммиак? Формула и свойства аммиака
Что такое аммиак? Формула и свойства аммиака Кремний и его соединения. Кремний в природе. Применение кремния
Кремний и его соединения. Кремний в природе. Применение кремния Газообразные вещества: примеры и свойства
Газообразные вещества: примеры и свойства Характеристика кальция. Свойства кальция. Формула кальция
Характеристика кальция. Свойства кальция. Формула кальция Физические и химические свойства серы
Физические и химические свойства серы Минимальная и максимальная степень окисления брома. Химические свойства брома
Минимальная и максимальная степень окисления брома. Химические свойства брома Угарный газ: формула и свойства
Угарный газ: формула и свойства
 Оксид азота (I, II, III, IV, V): свойства, получение, применение
Оксид азота (I, II, III, IV, V): свойства, получение, применение Чилийская селитра: формула и свойства. Химическая формула селитры
Чилийская селитра: формула и свойства. Химическая формула селитры