Fosforni hidroksid je formula, svojstva
Postoje tri klase složenih anorganskih spojeva: oksidi, hidroksidi (uključujući kiseline i baze), kao i soli. Mnogi metali i nemetali mogu stvarati okside, hidrokside, a također ulaze u sastav kiselih ostataka. Tako je fosfor uključen u kiseli ostatak PO4
sadržaj
- Fizikalna svojstva fosfora
- S gledišta kemije
- Interakcija s jednostavnim tvarima
- Interakcija s kompleksnim tvarima
- Fosfor i kiseline
- Fosfor i soli
- Priprema ovog ne-metala
- Fosforni spojevi i njihova svojstva
- Osnovna kemijska svojstva
- Reakcije fosforne kiseline s metalima
- Interakcija s bazama
- Fosforna kiselina i soli
- Korištenje fosfora i njegovih spojeva u industriji
- Struktura fosfornog atoma
- Prevalencija u prirodi
- Uloga fosfora i njegovih spojeva u prirodi i tijelu
- Nalazi
Fizikalna svojstva fosfora
Može postojati u različitim varijantama. Fosfor je tvar koja se sastoji od jednog kemijskog elementa. Njeni atomi ne kombiniraju se u molekule. Fosforna formula je P. Međutim, ovisno o strukturi kristalne rešetke, ovaj element može postojati kao tri tvari.
Najčešći bijeli fosfor - ima strukturu voska i visoku toksičnost. Tocka tališta ove tvari je četrdeset i četiri stupnja Celzijusa, a točka vrenja iznosi dvjesto i osamdeset stupnjeva. Kada trlja ovaj materijal, vrlo brzo se zapali, tako da ga rezati, samo stavljanjem u vodeni medij. Ako se dugo vremena zagrijava na temperaturi od dvije stotine i pedeset stupnjeva na Celzijevoj skali, pretvara se u crveni fosfor. Ova tvar je predstavljena u obliku smeđe-crvenog praha. Crveni fosfor, za razliku od bijelog, nije otrovan.
Najstabilniji oblik postojanja ovog elementa može se nazvati crni fosfor, koji je s nekim vanjskim znakovima sličan metalu: ima jedinstvenu sjaj, visoku tvrdoću, električnu i toplinsku vodljivost.
S gledišta kemije
Fosfor - kemijski element, što je u petoj skupini i trećem razdoblju u periodičnom stolu. Iz toga možemo zaključiti da je njezina valencija pet. Osim toga, iz periodičnog stanja može se vidjeti da element fosfor ima atomsku masu koja je jednaka trideset i jedan gram po molu. To znači da će 1 mola tvari težiti 31 grama. S obzirom na kemijska svojstva fosfora, govorit ćemo o njegovim reakcijama s jednostavnim i kompleksnim spojevima.
Interakcija s jednostavnim tvarima
Prva stvar koju trebate obratiti pozornost je oksidacija fosfora. Ovo je njegova reakcija s kisikom. Kao rezultat, mogu se formirati dvije različite tvari - sve će ovisiti o proporcijama tih komponenti.
Prva varijanta - od dva mola fosfora i tri mola kisika, formira se dva mola fosforovog trioksida. Možemo zapisati sličnu kemijsku interakciju koristeći sljedeću jednadžbu: 4P + 3O2 = 2P2oh3.
Druga mogućnost je stvaranje četiri mola fosfora i pet mola kisika od dva mola fosfornog pentoksida. Ova reakcija može se izraziti sljedećom jednadžbom: 4P + 5O2 = 2P2oh5.
U obje kemijske reakcije dolazi do značajnog oslobađanja svjetla. Osim toga, fosfor može komunicirati s takvim jednostavnim tvarima kao što su metali, halogeni (fluor, jod, brom, klor), sumpor. Ovaj kemijski element može pokazati i svojstva redukcije i oksidacije. Primjer interakcije s halogenom je kloriranje. Pojavljuje se u dvije faze. Prvo je stvaranje dvaju mola fosforovog triklorida iz dva mola spomenutog metala i tri mola klora. Ta se interakcija može izraziti pomoću sljedeće jednadžbe: 2P + 3Cl2= 2PCI3.
Druga faza ovog procesa je dodavanje atoma klora na već dobiveni fosforni triklorat. Stoga, kada se jedan klor dodaju u jedan mol istog volumena, nastaje jedan mol fosfornog pentaklorata. Zapisimo jednadžbu ove reakcije na slijedeći način: PCl3 + cl2 = PCl5.
U ovom primjeru mogu se razmotriti obrasci interakcije fosfora s metalima. Ako uzmemo tri mola kalija i jednog mola fosfora, dobivamo jedan mol kalijevog fosfida. Zapišite ovu vrstu postupka pomoću sljedeće reakcijske jednadžbe: 3K + P = K3R.
Interakcija s kompleksnim tvarima
Složenim kemijskim spojevima s kojima fosfor može reagirati uključuju kiseline i soli. Navedimo kako bi se značajke kontaktnog elementa o kojem je riječ s tim grupama kemijskih tvari.
Fosfor i kiseline
Između ostalog, posebno je istaknuto međudjelovanje fosfora i dušične kiseline. Da bi se izvršila ova vrsta reakcije potrebno je uzeti sljedeće sastojke: fosfor u količini od tri mola, pet mola dušične kiseline i vode - dva mola. Kao rezultat ove kemijske interakcije dobivamo sljedeće produkte: fosforna kiselina i dušikov oksid. Jednadžba za ovu reakciju napisana je kako slijedi: 3P + 5HNO3 + 3H2O = 3H3RO4 + 5NO.
Fosfor i soli
Takve kemijske interakcije mogu se razmotriti primjenom primjera reakcije ne-metala u vezi s cupram sulfatom. Za provedbu ovog postupka potrebno je uzeti dva mola fosfora, pet mola bakreni sulfat, osam mola vode. Kao rezultat interakcije ovih tvari, dobivamo sljedeće kemijske spojeve: sulfatnu kiselinu u količini od pet mola, čistog bakra - i fosforne kiseline - dva mola. Proces se može napisati u obliku sljedeće jednadžbe: 2P + 5CuSO4 + 8H2O = 5H2SO4 + 5Cu + 2H3RO4.
Priprema ovog ne-metala
U industriji se dotična tvar ekstrahira iz kemijskog spoja kao što je kalcij fosfata. Ovo se izvodi nakon kemijske reakcije: navedena sol miješa se s pijeskom (silika gel), a ugljik u molarnom omjeru 1: 3: 5, kako bi se dobio kalcijev silikat, fosfor i chadny plina u molarnom omjeru 3: 2: 5.
Fosforni spojevi i njihova svojstva
Najčešći spojevi predmeta koji nisu metalni su fosforov hidroksid. Može biti nekoliko vrsta ovisno o oksidu iz kojeg se formira. Fosforni hidroksid se može dobiti provođenjem kemijske reakcije između njegovog oksida i vode. Zbog takvih reakcija nastaju razne vrste tvari. Tako se iz trioksida može dobiti hidroksid (3) i fosforov hidroksid (5) iz pentoksida. Ove tvari imaju svojstva kiselosti i mogu, pak, reagirati s metalima, solima, bazama itd.
Najviši fosforov hidroksid je fosforna kiselina. To je kisik i trijezan. Njegova formula je H3RO4.
Osnovna kemijska svojstva
Fosforni hidroksid, čija je formula dan gore, može reagirati s obje jednostavne i složene tvari. Razmotrimo više tih procesa.
Reakcije fosforne kiseline s metalima
Poput drugih kemijskih spojeva ove klase, fosforov hidroksid je u mogućnosti komunicirati s metalima. Tijekom ovog procesa je reakcija supstitucije u kojima metalni atomi vodika atoma istiskivati, čime se dobije sol i vodik, raspršiti u zrak u obliku plina s neugodnog mirisa. Da bi se ta reakcija odvijala, metal mora biti smješten lijevo od vodika u seriji elektrokemijskih aktivnosti. To je, tvari poput bakra, srebra i drugih poput njih, nisu u stanju reagirati s fosfornom kiselinom, jer je zbog svoje niske reaktivnosti, oni neće biti u mogućnosti micati atome vodika iz svojih spojeva.
Na primjer, razmislite o aluminiju. Kada se dva mola ovog elementa dodaju u dva mola fosforovog hidroksida, dobili smo aluminij fosfat i vodik u količini od 2 i 3 mola. Jednadžba ove reakcije je napisana na sljedeći način: 2Al + 2H3RO4 = 2AlPO4 + 3H2.
Interakcija s bazama
Fosforni hidroksid, poput mnogih drugih kiselina, može ući u kemijske reakcije s bazama. Takvi se procesi nazivaju reakcije razmjene. Kao rezultat toga nastaje novi hidroksid, kao i nova kiselina. Takve se reakcije mogu provesti samo ako je jedan od dobivenih produkta netopljiv u vodi, tj. Taloži, isparava kao plin, ili je voda ili vrlo slab elektrolit.
Fosforna kiselina i soli
U ovom slučaju, postoji i reakcija zamjene. Kao rezultat toga, možete dobiti novu kiselinu i sol. Da bi se takva reakcija ostvarila, valjalo bi također primijetiti pravilo, koje je opisano upravo gore.
Korištenje fosfora i njegovih spojeva u industriji
Prije svega, spojevi ovog kemijskog elementa koriste se za izradu mješavine koja se primjenjuje na bočnoj površini okvira za slaganje. Također se obradi smjesa s sadržajem fosfora i sami glave šibica. Pentoksid od ne-metala u pitanju je naširoko koristi kao dehumidifier plina. Također se koristi u kemijskoj industriji kako bi se proizveo fosforov hidroksid, čija je formula i svojstva opisana gore. Osim toga, koristi se u proizvodnji stakla.
Pentoksid od ne-metala u pitanju je naširoko koristi kao dehumidifier plina. Također se koristi u kemijskoj industriji kako bi se proizveo fosforov hidroksid, čija je formula i svojstva opisana gore. Osim toga, koristi se u proizvodnji stakla.
Fosforni hidroksid također pronalazi primjenu u mnogim industrijama. Prije svega, koristi se u proizvodnji gnojiva. To je zbog činjenice da je za biljke fosfor jednostavno vitalan. Dakle, postoji niz različitih gnojiva koja se izrađuju na temelju spoja ne-metala u pitanju. U tu svrhu koriste se tvari poput kalcijevog fosfata. Sol se koristi kao gnojivo u obliku zemlje. Osim toga, za to se koriste obični i dvostruki superfosfati. Kao gnojivo može poslužiti i kao ammophos i nitroammophos. Uz sve gore navedeno, soli ili fosforov hidroksid se koriste kao reagensi za određivanje prisutnosti srebrnih spojeva u otopini. Dakle, dodajte tvar koja sadrži kiseli ostatak PO4, do rješenja. Ako potonji sadrži soli ili srebrni hidroksid, pojavit će se talog bogate žute boje. Ovo je argentum fosfat koji ima kemijsku formulu: AgNO3.
Struktura fosfornog atoma
Kao što je poznato, svi atomi se sastoje od jezgre i elektrona koji se okreću oko nje. Jezgra sadrži protone i neutrone. Elektroni imaju negativni naboj, protoni - pozitivni i neutroni - nula. Redni broj fosfora u periodičnom stolu iznosi petnaest. Iz toga se može zaključiti da u njegovoj jezgri ima petnaest protona. Ako je atom neutralan, a ne ion, onda su elektroni isti kao i protoni. To jest, u slučaju fosfora je petnaest.
Ako jedan od elektrona napusti svoju orbitu, atom će se pretvoriti u pozitivan naboj iona, tj. Kationa. Ako se jedan elektron pridružuje, nastaje negativno nabijen ion anion.
U periodičkom sustavu kemijskih elemenata može se vidjeti da fosfor pripada trećem razdoblju. Iz toga je jasno da oko jezgre postoje tri orbite na kojima su elektroni ravnomjerno raspoređeni. Na prvoj su dva, na drugom osam elektrona, a na trećem - pet.
Prevalencija u prirodi
Maseni udio fosfora u zemljinoj kori je 0,08%. To nije vrlo rasprostranjen kemijski element prirode. Međutim, postoji cijela grupa minerala, koji uključuju fosfor. To su apatii, kao i fosforiti. Najčešća prva skupina je fluorapatit. Njegova kemijska formula je sljedeća: 3Ca3(PO4)2• CaF2. Može biti prozirna, zelena i tirkizna. Među fosforitima, kalcijev fosfat je najrasprostranjeniji, sa sljedećom kemijskom formulom: Ca3(PO4)2. Osim toga, fosforni spojevi se nalaze u tkivima različitih živih organizama.
Uloga fosfora i njegovih spojeva u prirodi i tijelu
Ovaj kemijski element je vrlo važan za normalno funkcioniranje gotovo svih organa i njihovih sustava. Prije svega, bez nje, neprekinuti rad bubrega je nemoguć. Ovaj element sudjeluje u metaboličkim procesima tijela. Također promiče brzu regeneraciju tkiva. Bez nje, neki vitamini jednostavno ne mogu aktivirati da daju prednost tijelu - to je razlog zašto gotovo sve vitaminskih pripravaka često dopunjuju fosfor. Osim toga, to je jedan od kemijskih elemenata koji osiguravaju normalno funkcioniranje srca. On je, pored svega gore navedenog, uključen u proces diobe stanica, tako da je bez životnog mikroelementa na Zemlji nemoguće.
Regulacija ravnoteže vode i soli je druga funkcija koja se provodi u tijelu spojeva nefemata koji se smatraju u ovom članku. Osim toga, to je jedna od glavnih komponenti kostiju i mišićnog tkiva. Veliki postotak toga nalazi se u zubima. Između ostalog treba napomenuti da se fosfor uključi u normalno funkcioniranje živčanog sustava. Simptomi nedostatka mikroelemenata u organizmu smatra sljedeće: umor, slabu učinkovitost, smetnje u živčanom sustavu (neuroze, histerije, itd), previše česte prehlade, iscrpljenost srčanog mišića, bol u kostima i mišićima, vrlo slab apetit. Da biste izbjegli takav fenomen kao nedostatak fosfora u tijelu, morate znati koje proizvode sadrži. Prije svega, među proizvodima bogatim kemijskim elementom u pitanju, riba treba izolirati. Posebno visoka koncentracija fosfora opažena u takvim oblicima kao što jesetre, skuša, šnjura, tuna, srdela capelin, Pollock, topiti. Također je objašnjeno u ovom članku, mineral u tragovima naći u rakova mesa, škampi, kao iu mliječnim proizvodima kao što su sir, krem sir, sir.
Prije svega, među proizvodima bogatim kemijskim elementom u pitanju, riba treba izolirati. Posebno visoka koncentracija fosfora opažena u takvim oblicima kao što jesetre, skuša, šnjura, tuna, srdela capelin, Pollock, topiti. Također je objašnjeno u ovom članku, mineral u tragovima naći u rakova mesa, škampi, kao iu mliječnim proizvodima kao što su sir, krem sir, sir.
nalazi
Fosfor, iako ne vrlo uobičajen na planeti, kemijski je element, ali je od velike važnosti i iz industrijske i biološke točke gledišta. On i njegove veze, naročito, fosforov hidroksid, koriste se za proizvodnju različitih vrsta proizvoda. Također su opisane svojstva fosforovog hidroksida (fosforne kiseline) i njegove interakcije s metalima, bazama i solima.
 Što je složena tvar? Kako se to događa?
Što je složena tvar? Kako se to događa? Kvalitativne reakcije na organske tvari, anione, katione
Kvalitativne reakcije na organske tvari, anione, katione Oksidi, soli, baze, kiseline. Svojstva oksida, baza, kiselina, soli
Oksidi, soli, baze, kiseline. Svojstva oksida, baza, kiselina, soli Anorganske tvari
Anorganske tvari Koja je priroda oksida
Koja je priroda oksida Fosforni oksid
Fosforni oksid Bazični hidroksidi i njihova kemijska svojstva
Bazični hidroksidi i njihova kemijska svojstva Alkali metali
Alkali metali Klase anorganskih spojeva
Klase anorganskih spojeva Kromov oksid
Kromov oksid Bijeli fosfor, crvena i crna - svojstva i primjena
Bijeli fosfor, crvena i crna - svojstva i primjena Amfoterni metali i njihova svojstva
Amfoterni metali i njihova svojstva Kiseli oksidi: kratki opis skupine
Kiseli oksidi: kratki opis skupine Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje
Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje Osnovni oksidi i njihova svojstva
Osnovni oksidi i njihova svojstva Oksidi, oksidi koji formiraju natrij i koji ne stvaraju soli
Oksidi, oksidi koji formiraju natrij i koji ne stvaraju soli Kemijska svojstva soli i postupci za njihovo dobivanje
Kemijska svojstva soli i postupci za njihovo dobivanje Anorganske tvari: primjeri i svojstva
Anorganske tvari: primjeri i svojstva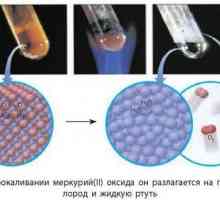 Oksidi. Primjeri, klasifikacija, svojstva
Oksidi. Primjeri, klasifikacija, svojstva Fosforni - metalni ili nemetalni? Element Properties
Fosforni - metalni ili nemetalni? Element Properties Amfoterni hidroksidi su tvari dvostruke prirode
Amfoterni hidroksidi su tvari dvostruke prirode
 Kvalitativne reakcije na organske tvari, anione, katione
Kvalitativne reakcije na organske tvari, anione, katione Oksidi, soli, baze, kiseline. Svojstva oksida, baza, kiselina, soli
Oksidi, soli, baze, kiseline. Svojstva oksida, baza, kiselina, soli Koja je priroda oksida
Koja je priroda oksida Bazični hidroksidi i njihova kemijska svojstva
Bazični hidroksidi i njihova kemijska svojstva