Kemijska veza: definicija, vrste, klasifikacija i značajke definicije
Koncept kemijskog povezivanja nema malog značaja u različitim područjima kemije kao znanosti. To je zbog činjenice da je sa svojom pomoći da se pojedini atomi mogu kombinirati u molekule, stvarajući sve vrste tvari, koje zauzvrat predstavljaju kemijsko istraživanje.
sadržaj
S različitim atoma i molekula povezana je pojava različitih vrsta veza između njih. Za različite klase molekula postoje karakteristične značajke distribucije elektrona, a time i njihovih vlastitih vrsta veza.
Osnovni pojmovi
Kemijsko vezivanje (molekule, ioni, radikali), kao i agregati (kristali, naočale i drugi). Priroda ovih interakcija je električne prirode, a nastaju kada se valentni elektroni raspoređuju pri približavanju atoma.
Valencija je prihvaćena nazvati sposobnost atoma da oblikuje određeni broj veza s drugim atomima. U ionskim spojevima vrijedi valencija kao broj elektrona koji se šalju ili pričvršćuju. U kovalentnim spojevima jednak je broju zajedničkih elektronskih parova.
ispod stupanj oksidacije podrazumijeva uvjet naboj koji bi mogao biti na atomu ako sve polarne kovalentne veze imaju ionski karakter.
Pozivaju se kratke komunikacije broj socijaliziranih parova elektrona između atoma koji se razmatraju.
Poveznice koje se razmatraju u različitim dijelovima kemije mogu se podijeliti u dvije vrste kemijskih veza: one koje dovode do stvaranja novih tvari (intramolekularni), i one koje nastaju između molekula (intermolekularni).
Glavne značajke komunikacije
Moć komunikacije nazivamo energijom koja je potrebna da razbije sve raspoložive veze u molekuli. Također je energija koja se oslobađa tijekom formiranja veze.

Duljina veze zove se udaljenost između susjednih jezgri atoma u molekuli, pod kojima su snage privlačnosti i odbijanja uravnotežene.
Ove dvije karakteristike kemijskog vezanja atoma su mjera njezine snage: što kraća duljina i što je veća energija, to je jača veza.
Valentni kut uobičajeno je nazvati kut između predstavljenih linija koja prolaze duž smjera komunikacije kroz atomske jezgre.
Metode za opis odnosa
Najčešći su dva pristupa objašnjavanju kemijske veze, posuđene iz kvantne mehanike:
Metoda molekularnih orbitala. Smatra molekulu kao zbirku elektrona i atomske jezgre, pri čemu se svaki pojedini elektron kreće u području djelovanja svih ostalih elektrona i jezgri. Molekula ima orbitalnu strukturu, a svi su njegovi elektroni raspoređeni duž ovih orbita. Također se ova metoda naziva MO LCAO, koja označava "molekularnu orbitalnu - linearnu kombinaciju atomskog orbitala".
Metoda valentnih veza. Predstavlja molekulu sustavom od dva središnja molekularna orbita. U ovom slučaju, svaki od njih odgovara jednoj vezi između dva susjedna atoma u molekuli. Metoda se temelji na sljedećim odredbama:
- Kemijska se veza sastoji od para elektrona koji imaju suprotne vrline, koji se nalaze između dva atoma koji se razmatraju. Pripravljeni elektronski parovi jednako su dva atoma.
- Broj veza nastalih ovim ili onim atomom jednak je broju nesparenih elektrona u tlu i uzbudjenom stanju.
- Ako elektronski parovi ne sudjeluju u formiranju komunikacije, oni se nazivaju nevezani.
Elektronegativnost
Odrediti vrstu kemijske veze u tvari može se temeljiti na razlici u vrijednostima elektronegativnosti njegovih sastavnih atoma. ispod Elektronegativnost razumjeti sposobnost atoma da povuku na sebe zajedničke elektronske parove (elektronički oblak), što dovodi do polarizacije veze.
Postoje razni načini za određivanje vrijednosti elektronegativnosti kemijskih elemenata. Međutim, najviše se primjenjuje mjerilo temeljeno na termodinamičkim podacima, koje je već 1932. predložio L. Pauling.

Što je značajnija razlika u elektronegativnosti atoma, to je izraženija ionicitet. Naprotiv, jednake ili bliske vrijednosti elektronegativnosti ukazuju na kovalentnu prirodu veze. Drugim riječima, moguće je utvrditi koja je kemijska veza promatrana u molekuli, matematički. Da biste to učinili, izračunajte Delta-X - razlika elektroniegativnosti atoma prema formuli: Delta-X = | X1-X2|.
- Ako je Delta-X> 1,7, tada je veza ionska.
- Ako je 0,5le-delta-Hle-1,7, tada je kovalentna veza polarna.
- Ako je Delta-X = 0 ili blizu nje, tada se veza odnosi na kovalentni nepolarni.
Ion vezivanje
Ion je veza koja se pojavljuje između iona ili zbog potpunog povlačenja zajedničkog elektronskog para jednog od atoma. U supstancama ova vrsta kemijskog vezanja provodi se sila elektrostatske privlačnosti.
Ioni se napajaju čestice formirane iz atoma kao rezultat dodavanja ili oslobađanja elektrona. Ako atom uzima elektrone, dobiva negativni naboj i postaje anion. Ako atom odašilje valentne elektrone, postaje pozitivno nabijenom česticom, nazvanom kation.
Tipičan je za spojeve koji nastaju međudjelovanjem atoma tipičnih metala s atomima tipičnih nemetala. Srž ovog procesa je želja atoma da steknu stabilne elektroničke konfiguracije. A za tipične metale i ne-metale za to, morate dati ili uzeti samo 1-2 elektrona, koji oni lako učiniti.

Mehanizam ionske kemijske veze u molekuli tradicionalno se razmatra na primjeru interakcije natrija i klora. Atomi alkalijskog metala lako odustaju od elektrona koji je vukao halogeni atom. Kao rezultat toga, na Na kation+ i anion Cl-, koji se drže zajedno elektrostatičkom privlačenjem.
Ne postoji idealna ionska veza. Čak iu takvim spojevima, koji se često nazivaju ionskim spojevima, nema konačnog prijelaza elektrona od atoma do atoma. Generirani par elektrona i dalje ostaje u uobičajenoj upotrebi. Stoga se govori o stupnju ioniciteta kovalentne veze.
Ionsku vezu karakteriziraju dvije osnovne značajke koje se odnose jedna na drugu:
- ne-usmjerenost, tj. električno polje oko ionskog oblika ima oblik kugle;
- nezasićenost, tj., broj suprotno nabijenih iona koji se mogu staviti oko iona određuje se njihovom veličinom.
Kovalentna kemijska veza
Povezivanje nastaje kada se preklapaju elektronski oblaci nemetalnih atoma, tj. Ostvaruju zajedničkim elektronskim parom, zove se kovalentna veza. Broj socijaliziranih parova elektrona određuje višestruku vezu. Tako su atomi vodika vezani jednostrukom vezom Hmiddot-middot-H, a atomi kisika tvore dvostruku vezu O :: O.
Postoje dva mehanizma za njegovo stvaranje:
- Razmjena - svaki atom je za stvaranje zajedničkog para jednog elektrona: Amiddot- + middot-B = A: B, dok vanjske atomske orbitale sudjeluju u komunikaciji na kojoj se nalazi jedan elektron.
- Donator-akceptor - za stvaranje veze, jedan od atoma (donatora) osigurava par elektrona, a drugi (akceptor) - slobodni orbital za njegovo postavljanje: A +: B = A: B.

Različite su metode preklapanja elektronskih oblaka tijekom formiranja kovalentne kemijske veze.
- Izravno. Oblak preklapanja oblaka leži na liniji imaginarne crte koja povezuje jezgre atoma koji se razmatraju. U ovom slučaju, sigma - povezivanje. Od vrste oblaka elektrona koji se preklapaju, vrsta kemijske veze koja ovisi: s-s, s-p, p-p, s-d ili p-d sigma - povezivanje. U čestici (molekuli ili ionu) između dva susjedna atoma, samo jedan sigma - povezivanje.
- Bočni. Odvija se na obje strane linije koja povezuje jezgre atoma. Tako je pi je veza, a njegove sorte su također moguće: p-p, p-d, d-d. Odvojena od sigma - povezivanje pi - veza nikada nije formirana, može biti u molekulama koje sadrže višestruke (dvostruke i trostruke) veze.

Kovalentna svojstva veza
Oni određuju kemijska i fizička svojstva spojeva. Glavna svojstva svake kemijske veze u tvari su njegova usmjerenost, polarizacija i polarizacija, kao i zasićenje.
trend određene su specifičnosti molekularne strukture tvari i geometrijski oblik njihovih molekula. Njegova je bit u činjenici da je najbolje preklapanje elektronskih oblaka moguće za određenu orijentaciju u prostoru. Opcije visokog obrazovanja već su razmotrene sigma i pi - veza.
ispod saturability razumjeti sposobnost atoma da oblikuju određeni broj kemijskih veza u molekuli. Broj kovalentnih veza za svaki atom je ograničen brojem vanjskih orbitala.
polaritet veza ovisi o razlici u vrijednostima elektronegativnosti atoma. Određuje ujednačenost distribucije elektrona između atomskih jezgri. Kovalentna veza na ovu osobinu može biti polarna ili nepolarna.
- Ako zajednički elektronski par pripada jednako svakom od atoma i nalazi se na istoj udaljenosti od jezgri, onda je kovalentna veza nepolarna.
- Ako se ukupni par elektrona premjesti u jezgru jednog od atoma, nastaje kovalentna polarna kemijska veza.
polarizabilnost izražava se pomicanjem elektronskih veza pod djelovanjem vanjskog električnog polja, koje mogu pripadati drugoj čestici, susjednim vezama u istoj molekuli ili potječu od vanjskih izvora elektromagnetskih polja. Dakle, kovalentna veza pod njihovim utjecajem može promijeniti polarnost.
Hibridizacija orbita podrazumijeva promjenu njihovih oblika tijekom kemijske veze. To je nužno za postizanje najučinkovitijih preklapanja. Postoje sljedeće vrste hibridizacije:
- sp3. Jedan s- i tri P-orbita formiraju četiri "hibridna" orbita istog oblika. Izvana izgleda kao tetraedar s kutom između osi 109 °.
- sp2. Jedan s i dva P-orbita čine ravni trokut s kutom između osi od 120 °.
- sp. Jedan s- i jedan p-orbitalni oblik dva "hibridna" orbita s kutom između svojih osi od 180 °.
Metalno lijepljenje
Posebnost strukture metalnih atoma je prilično velik radijus i prisutnost malog broja elektrona u vanjskim orbitalima. Kao posljedica toga, u takvim kemijskim elementima, veza između jezgre i valentnih elektrona relativno je slaba i lako je slomljena.
metalni ova interakcija naziva se interakcijom između atoma metala i atoma koji se ostvaruju pomoću delokaliziranih elektrona.
U metalnim česticama, valentni elektroni mogu lako napustiti vanjske orbite, jer, zaista, zauzimaju prazna mjesta na njima. Tako, u različitim vremenima, iste čestice mogu biti atom i ion. Elektroni koji su se odvojili slobodno kreću kroz cijeli volumen kristalne rešetke i izvode kemijsku vezu.

Ova vrsta veze ima sličnosti s ionskim i kovalentnim vezama. Kao i za ionske, postojanje metalne veze zahtijeva ione. Ali ako su za realizaciju elektrostatske interakcije u prvom slučaju kationi i anioni potrebni, onda u drugom slučaju ulogu negativno nabijenih čestica igraju elektroni. Ako uspoređujemo metalnu vezu s kovalentnom vezom, tada za formiranje oba, potrebni su zajednički elektroni. Međutim, za razliku od polarne kemijske veze, one nisu lokalizirane između dva atoma, već pripadaju svim metalnim česticama u kristalnoj rešetki.
Metalna veza je zbog posebnih svojstava gotovo svih metala:
- plastičnost, prisutna zbog mogućnosti pomicanja slojeva atoma u kristalnoj rešetki koju drži elektronni plin;
- metalni sjaj, koji se opaža zbog refleksije svjetlosnih zraka iz elektrona (u stanju praha nema kristalne rešetke i, prema tome, elektroni koji se kreću duž njega);
- električna provodljivost koja se provodi strujom nabijenih čestica, a u ovom slučaju, mali elektroni se slobodno kreću među velikim metalnim ionima;
- toplinska provodljivost, opaženo je zbog sposobnosti elektrona da prenose toplinu.
Vodikova veza
Ova vrsta kemijske veze ponekad se naziva intermedijer između kovalentnih i intermolekularnih interakcija. Ako je vodik povezan s jako elektronegativne elemenata (kao što su fosfor, kisik, klora, dušika) je sposoban formirati dodatnu vezu, pod nazivom vodik.
Mnogo je slabiji od svih vrsta veza koje je gore spomenuto (energija koja nije veća od 40 kJ / mol), ali se ne može zanemariti. Zato vodikova veza na dijagramu izgleda kao crtkana crta.

Pojava vodikove veze je moguća istodobno zbog elektrostatske interakcije donatora-akceptora. Velika razlika u vrijednostima elektronegativnosti dovodi do pojave viška elektronske gustoće na O, N, F i drugim atomima, kao i na njegov nedostatak na atomu vodika. U slučaju da nema postojećih kemijskih veza između takvih atoma, ako su dovoljno blizu, aktiviraju se sile privlačenja. U ovom slučaju, proton je akceptor elektronskog para, a drugi atom je donator.
Hidrogen veza može pojaviti između susjednih molekula, kao što su voda, alkoholi, karboksilne kiseline, amonijak, a unutar molekule, kao što je salicilna kiselina.
Prisutnost vodikove veze između molekula vode objašnjava brojna jedinstvena fizička svojstva:
- Vrijednosti njegovog toplinskog kapaciteta, dielektrična konstanta, vrenja i tališta u skladu s proračunima trebala biti znatno manja nego stvarna, jer srodnosti molekula i potrebu trošiti energiju razbiti intermolekularne vodikove veze.
- Za razliku od drugih tvari, uz smanjenje temperature, volumen vode se povećava. To je zbog činjenice da molekule zauzimaju određeno mjesto u kristalnoj strukturi leda i odvojene su jedna od druge dužinom vodikove veze.
Taj odnos igra posebnu ulogu za žive organizme, jer njegova prisutnost u proteinskim molekulama određuje njihovu posebnu strukturu, a time i svojstva. Osim toga, nukleinske kiseline, koje čine dvostruku spiralu DNA, također su vezane vodikovim vezama.
Priključci u kristalima
Velika većina čvrstih tijela ima kristalnu rešetku - poseban međusobni raspored čestica koje ih oblikuju. U ovom slučaju, promatra se trodimenzionalna periodičnost, a na čvorovima se nalaze atomi, molekule ili ioni koji su povezani imaginarnim linijama. Ovisno o prirodi tih čestica i njihovim odnosima, sve kristalne strukture podijeljene su na atomsku, molekularnu, ionsku i metalnu.
Na mjestima ionske kristalne rešetke su kationi i anioni. I svaki od njih je okružen strogo definiranim brojem iona sa samo suprotnim nabojem. Tipičan primjer je natrijev klorid (NaCl). Za njih su visoke točke topljenja i tvrdoća uobičajene, jer je potrebno mnogo energije da ih uništi.
Na čvorovima molekularne kristalne rešetke su molekule tvari koje tvore kovalentna veza (na primjer, I2). One su međusobno povezane slabom interakcijom van der Waals, i time je ta struktura lako uništena. Takvi spojevi imaju nisku točku vrenja i tališta.
Atomska kristalna rešetka formiraju atomi kemijskih elemenata koji posjeduju visoke vrijednosti valencije. Oni su vezani jakim kovalentnim vezama, što znači da su tvari karakterizirane visokim vrelištem, topljenjem i velikom tvrdoćom. Primjer je dijamant.
Dakle, sve vrste veza dostupnih u kemijskim tvarima imaju svoje osobitosti, koje objašnjavaju zamršene interakcije čestica u molekulama i supstancama. Svojstva tih spojeva ovise o njima. Oni određuju sve procese koji se odvijaju u okolišu.
 Kakva je valencija sumpora? Moguće valencije sumpora
Kakva je valencija sumpora? Moguće valencije sumpora Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata Strukturna i molekulska formula: acetilen
Strukturna i molekulska formula: acetilen Koja je kisika kisika u spojevima?
Koja je kisika kisika u spojevima?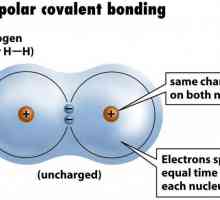 Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna
Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna Donja-akceptorska veza: primjeri tvari
Donja-akceptorska veza: primjeri tvari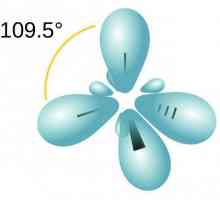 Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije Kako odrediti stupanj oksidacije
Kako odrediti stupanj oksidacije Kako odrediti valenciju
Kako odrediti valenciju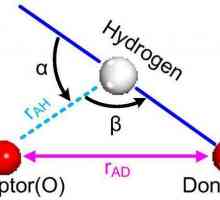 Vodikova veza: primjeri i vrste kemijskih veza
Vodikova veza: primjeri i vrste kemijskih veza Glavne vrste kemijskih veza: zašto i kako se formiraju
Glavne vrste kemijskih veza: zašto i kako se formiraju Kovalentna veza
Kovalentna veza Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva
Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva Dielektrika u električnom polju
Dielektrika u električnom polju Što je vodikova veza? Vrste, utjecaj
Što je vodikova veza? Vrste, utjecaj Kristalna rešetka i glavni tipovi
Kristalna rešetka i glavni tipovi Ionska kristalna rešetka
Ionska kristalna rešetka Što je kovalentna polarna veza
Što je kovalentna polarna veza Metalno lijepljenje
Metalno lijepljenje Ion vezivanje
Ion vezivanje Kovalentna nepolarna veza je kemijska veza koju čine identični atomi
Kovalentna nepolarna veza je kemijska veza koju čine identični atomi
 Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata Strukturna i molekulska formula: acetilen
Strukturna i molekulska formula: acetilen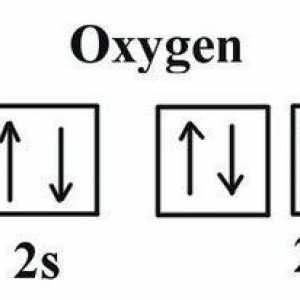 Koja je kisika kisika u spojevima?
Koja je kisika kisika u spojevima?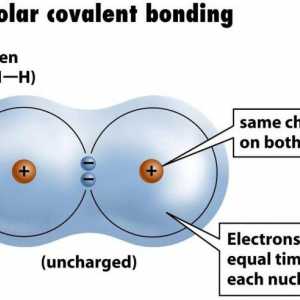 Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna
Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna Donja-akceptorska veza: primjeri tvari
Donja-akceptorska veza: primjeri tvari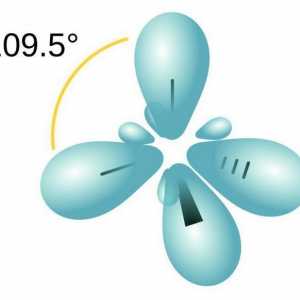 Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije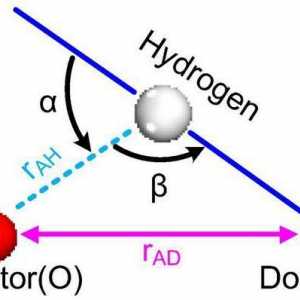 Vodikova veza: primjeri i vrste kemijskih veza
Vodikova veza: primjeri i vrste kemijskih veza