Anorganske tvari: primjeri i svojstva
Svaki dan osoba interakciju s velikim brojem objekata. Izrađene su od različitih materijala, imaju vlastitu strukturu i sastav. Sve što okružuje osobu može se podijeliti na organske i anorganske. U članku ćemo razmotriti što su te tvari, dajte primjere. Također određujemo koje su anorganske tvari pronađene u biologiji.
sadržaj
opis
Anorganske su tvari bez sadržaja ugljika. Oni su suprotno organskom. Isto tako ove skupine uključuju nekoliko spojeva koji sadrže ugljik, na primjer:
- cijanida;
- ugljični oksidi;
- karbonati;
- karbida i drugih.
Primjeri anorganskih tvari:
- voda;
- različite kiseline (klorovodična, dušična, sumporna);
- sol;
- amonijak;
- Ugljični dioksid;
- metala i nemetala.
Anorganska grupa se odlikuje nepostojanjem ugljikovog skeleta, koji je karakterističan za organske tvari. Anorganske tvari u sastavu obično se dijele na jednostavne i složene. Jednostavne tvari čine malu skupinu. U svemu postoji oko 400.

Jednostavni anorganski spojevi: metali
Metali su jednostavne tvari čiji se spoj atoma temelji na metalnoj vezi. Ti elementi imaju karakteristična metalna svojstva: toplinska provodljivost, električna vodljivost, duktilnost, sjaj i ostalo. U ovoj skupini ima 96 elemenata. To uključuje:
- alkalijski metali: litij, natrij, kalij;
- zemnoalkalijski metali: magnezij, stroncij, kalcij;
- Prijelazni metali: bakar, srebro, zlato;
- lakih metala: aluminij, kositar, olovo;
- semimetali: polonija, muskova, nihonija;
- lantanidi i lantan: skandium, itrij;
- aktinidi i aktinium: uranij, neptunij, plutonij.
Uglavnom u prirodi, metali se nalaze u obliku rude i spojeva. Da bi se dobio čisti metal bez nečistoća, provodi se pročišćavanje. Ako je potrebno doping ili druga obrada je moguća. Ovo je posebna znanost - metalurgija. Podijeljena je na crnu i boja.

Jednostavni anorganski spojevi: nonmetali
Nemetali su kemijski elementi koji nemaju metalna svojstva. Primjeri anorganskih tvari:
- voda;
- dušik;
- sumpor;
- kisika i drugih.
Ne-metali razlikuju se od velikog broja elektrona na vanjskoj razini energije njihovog atoma. To uzrokuje određena svojstva: povećava se sposobnost priključivanja dodatnih elektrona, pojavljuje se veća oksidativna aktivnost.
U prirodi, možete naći non-metale u slobodnom stanju: kisik, klor, fluor, vodik. I također krute oblike: jod, fosfor, silikon, selen.
Neki od nemetala imaju osebujnu imovinu - alotropiju. To jest, oni mogu postojati u različitim modifikacijama i oblicima. Na primjer:
- plinoviti kisik ima modifikacije: kisik i ozon;
- čvrsti ugljik može postojati u takvim oblicima: dijamant, grafit, stakleni ugljik i drugi.

Složeni anorganski spojevi
Ova skupina tvari je brojnija. Složene veze razlikuju se u prisutnosti nekoliko kemijskih elemenata u sastavu tvari.
Razmotrimo detaljnije složene anorganske tvari. Primjeri i njihova klasifikacija prikazani su u nastavku u članku.
1. Oksidi su spojevi, jedan od čijih je elemenata kisik. Grupa uključuje:
- ne-soli (npr. ugljični monoksid, dušični oksid);
- oksidi koji stvaraju soli (na primjer, natrijev oksid, cinkov oksid).
2. Kiseline - tvari koje sadrže vodikove ione i kisele ostatke. Na primjer, dušična kiselina, sumporna kiselina, vodikov sulfid.
3. Hidroksidi su spojevi u kojima je prisutna -OH skupina. klasifikacija:
- baze - topive i netopive lužine - bakreni hidroksid, natrijev hidroksid;
- Kiseline koje sadrže kisik - trihidroksid karbonat, vodik trioksonitrat;
- amfoterno - kromov hidroksid, bakreni hidroksid.
4. Soli su tvari u kojima postoje metalni ioni i kiseli ostatci. klasifikacija:
- medij: natrijev klorid, željezni sulfid;
- kiselina: natrijev hidrogenkarbonat, hidrogen sulfati;
- osnovni: nitrat dihidroksikrom, nitrat hidroksokrom;
- kompleks: natrijev tetrahidroksocinat, kalijev tetrakloroplatinat;
- dvostruka: alum kalum;
- mješoviti: kalij aluminij sulfat, kalijev klorid klorid.
5. Binarni spojevi - tvari koje se sastoje od dva kemijska elementa:
- anoksične kiseline;
- soli bez kisika i druge.

Anorganski spojevi koji sadrže ugljik
Takve tvari tradicionalno pripadaju skupini anorganskih tvari. Primjeri tvari:
- Karbonati - esteri i soli karbonske kiseline - kalcit, dolomit.
- Karbidi - spojevi nemetala i metala s ugljičnim - berilijim karbidom, kalcijevim karbidom.
- Cijanidi - soli cijanovodične kiseline - natrijev cijanid.
- Ugljikovi oksidi su binarni spoj ugljika i kisika - ugljični monoksid i ugljični dioksid.
- Cianati - dobiveni su od cijanovske kiseline - fulminske kiseline, izocijaninske kiseline.
- Karbonilni metali - kompleks metala i ugljičnog monoksida - nikal karbonil.

Svojstva anorganskih tvari
Sve tvari smatraju se različitim u njihovim pojedinačnim kemijskim i fizikalnim svojstvima. Općenito, moguće je razlikovati razlikovne značajke svake klase anorganskih tvari:
1. Jednostavni metali:
- visoka toplinska i električna vodljivost;
- metalik sjaj;
- nedostatak transparentnosti;
- snaga i duktilnost;
- na sobnoj temperaturi zadržavaju svoju tvrdoću i oblik (osim žive).
2. Jednostavni nemetali:
- jednostavni nemetali mogu biti u plinovitom stanju: vodik, kisik, klor;
- Brom se nalazi u tekućem stanju;
- čvrsti nemetali imaju ne-molekularno stanje i mogu oblikovati kristale: dijamant, silicij, grafit.
3. Kompleksne tvari:
- oksidi: reagiraju s vodom, kiselinama i kiselim oksidima;
- kiseline: reagiraju s vodom, bazični oksidi i alkali;
- amfoterni oksidi: mogu reagirati s kiselim oksidima i bazama;
- hidroksidi: otapaju se u vodi, imaju širok raspon točke topljenja, mogu mijenjati boju kod interakcije s alkalijama.

Organske i anorganske tvari
Stanica bilo kojeg živog organizma sastoji se od mnogih komponenti. Neki od njih su anorganski spojevi:
- Voda. Na primjer, količina vode u stanici je od 65 do 95%. Potrebno je za primjenu kemijskih reakcija, kretanje komponenata, proces termoregulacije. Također je voda koja određuje volumen ćelije i stupanj njegove elastičnosti.
- Mineralne soli. Oni mogu biti prisutni u tijelu i u otopljenom obliku iu neotopljenom. Kations kao što su kalij, natrij, kalcij, magnezij i anioni: klor, hidrogenkarbonat, superfosfat igraju važnu ulogu u staničnim procesima. Minerali su neophodni za održavanje osmotske ravnoteže, regulaciju biokemijskih i fizikalnih procesa, formiranja živčanih impulsa, održali zgrušavanja krvi i mnoge druge reakcije.
Za održavanje vitalne aktivnosti, ne samo anorganske tvari stanice su važne. Organske komponente zauzimaju 20-30% volumena.
klasifikacija:
- jednostavne organske tvari: glukoza, aminokiseline, masne kiseline;
- složene organske tvari: proteini, nukleinske kiseline, lipidi, polisaharidi.
Organske komponente potrebne za obavljanje zaštitne, funkcije stanične energije, oni služe kao izvor energije za aktivnost stanica i trgovina hranjivih tvari, sinteza proteina se provodi, genetske informacije prenose.
U članku se ispituje suština i primjeri anorganskih tvari, njihova uloga u stanici. Može se reći da bi postojanje živih organizama bilo nemoguće bez skupina organskih i anorganskih spojeva. Oni su važni u svakom području ljudskog života, kao iu postojanju svakog organizma.
 Što je složena tvar? Kako se to događa?
Što je složena tvar? Kako se to događa? Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari
Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari Razvrstavanje organskih tvari - osnova za proučavanje organske kemije
Razvrstavanje organskih tvari - osnova za proučavanje organske kemije Organski materijal njihovih svojstava i klasifikacije
Organski materijal njihovih svojstava i klasifikacije Kvalitativne reakcije na organske tvari, anione, katione
Kvalitativne reakcije na organske tvari, anione, katione Koje su tvari? Koje su tvari u prirodi?
Koje su tvari? Koje su tvari u prirodi? Ciklus tvari u biosferi
Ciklus tvari u biosferi Anorganske tvari
Anorganske tvari Koja je priroda oksida
Koja je priroda oksida Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari Kako pronaći molarnu masu
Kako pronaći molarnu masu Organska pitanja: primjeri. Primjeri stvaranja organskih i anorganskih tvari
Organska pitanja: primjeri. Primjeri stvaranja organskih i anorganskih tvari Anorganska kemija. Opća i anorganska kemija
Anorganska kemija. Opća i anorganska kemija Organski spojevi i njihova klasifikacija
Organski spojevi i njihova klasifikacija Jednostavne tvari
Jednostavne tvari Najveće ćelije organske tvari
Najveće ćelije organske tvari Osnovni oksidi i njihova svojstva
Osnovni oksidi i njihova svojstva Organske i anorganske tvari
Organske i anorganske tvari Oksidi, oksidi koji formiraju natrij i koji ne stvaraju soli
Oksidi, oksidi koji formiraju natrij i koji ne stvaraju soli Glavni dijelovi kemije: opis, značajke i zanimljive činjenice
Glavni dijelovi kemije: opis, značajke i zanimljive činjenice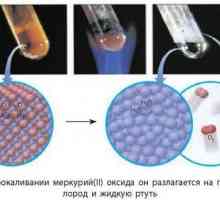 Oksidi. Primjeri, klasifikacija, svojstva
Oksidi. Primjeri, klasifikacija, svojstva
 Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari
Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari Kvalitativne reakcije na organske tvari, anione, katione
Kvalitativne reakcije na organske tvari, anione, katione Koje su tvari? Koje su tvari u prirodi?
Koje su tvari? Koje su tvari u prirodi? Koja je priroda oksida
Koja je priroda oksida Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari