Kakvo je uzbuđeno stanje atoma
, 1905 J. Thompson prvo predložen model atomske strukture, prema kojemu je pozitivno nabijen u loptu, koji su raspoređeni sa negativnim čestica naboja - elektrona. Električna neutralnost atoma je objašnjena jednakošću naboja kugle i svih njegovih elektrona.
sadržaj
Na mjesto ove teorije u 1911., došao do planetarnog modela, izrađen od strane Rutherford: u središtu jezgre zvijezde, čine većinu svih atoma u orbitama oko elektrona, planeti vrte. Međutim, u budućnosti, rezultati eksperimenata ispitivali su ispravnost ovog modela. Na primjer, formulama Rutherford slijedi da je brzina elektrona i njihovih polumjera može mijenjati kontinuirano. U ovom slučaju, kontinuirano zračenje bilo bi opaženo kroz spektar. Međutim, rezultati eksperimenata upućuju na linearni spektar atoma. Postoje i neke druge proturječnosti. Nakon toga, N. Bohr je predložio kvantni model struktura atoma. Potrebno je naglasiti tlo i uzbuđeno stanje atoma. Ova karakteristika omogućuje, osobito, objašnjenje valencije elementa.
Uzbudljivo stanje atoma je međuprostor između države s nultom razinom energije i prekoračenja. Izuzetno je nestabilno, stoga vrlo kratkotrajno - trajanje je milijun sekunde sekunde. Uzbudljivo stanje atoma nastaje kada se dodaju dodatna energija. Na primjer, njegov izvor može biti temperatura djelovanja i elektromagnetska polja.
U pojednostavljenom obliku klasične teorije atomske strukture navodi da oko jezgre na određenim razmacima duž kružne orbite rotirati nedjeljive negativno nabijene čestice - elektroni. Svaka putanja nije linija, kao što svibanj činiti, a energija „oblak” s nekoliko elektrona. Osim toga, svaki elektron ima vlastiti spin (okreće se oko svoje osi). Bilo radijus elektrona orbita ovisi o razini energije, tako da u nedostatku vanjskog utjecaja unutarnje strukture je dovoljno stabilna. Njegova povreda - pobuđenog stanja atoma -nastupaet kada su vanjske izvješća energije. Kao posljedica toga, u zadnjim putevima, gdje je sila interakcije s jezgrom mala, parenje rotiraju se u elektronima, a kao posljedica toga dolazi do njihova prijelaza na prazne stanice. Drugim riječima, u skladu s zakon o očuvanju energije prijelaz elektrona na višu razine energije prati apsorpcija kvage.
Razmotrimo uzbuđeno stanje atoma na primjeru arenskog atoma (As). Njegova valencija je tri. Zanimljivo je da ova vrijednost vrijedi samo za slučaj kada je element u slobodnom stanju. Od valence određuje broj okretaja nesparenih, po primitku vanjsko napajanje atom na mjestu zadnje putanja uočeno pari čestice prijelaz na slobodne stanice. Kao rezultat toga, orbita se mijenja. Budući da su energije podrazine jednostavno obrnuta, onda vratiti natrag (rekombinacija), osnovnog stanja atoma, u pratnji evolucije apsorbirane energije kao fotoni ekvivalent. Povrat na primjer arsena: zbog promjene u broju okretaja nesparen u pobuđenom stanju odgovara valenciji elementa pet.
Shematski, prethodno je kako slijedi: kada prima energiju iz vanjskog dijela vanjskog atoma elektrona pomaknut veću udaljenost od jezgre (radijusa kruže povećava). Međutim, budući da proton u jezgri ostaje, ukupna vrijednost unutarnja energija atom postaje veći. U nedostatku kontinuiranog opskrbe vanjskom energijom, elektron se vrlo brzo vraća u svoju bivšu orbitu. U ovom slučaju, višak njegove energije se oslobađa u obliku elektromagnetskog zračenja.
 Ukratko, modeli atoma Thomsona i Rutherforda
Ukratko, modeli atoma Thomsona i Rutherforda Planetarni model Rutherforda, atom u modelu Rutherford
Planetarni model Rutherforda, atom u modelu Rutherford Struktura atoma. Kvantno-mehanički model atoma
Struktura atoma. Kvantno-mehanički model atoma Atomska jezgra. Otkrivanje tajni
Atomska jezgra. Otkrivanje tajni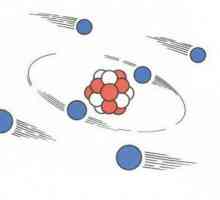 Razgovarajmo o tome kako pronaći protone, neutrone i elektrone
Razgovarajmo o tome kako pronaći protone, neutrone i elektrone Radioaktivne transformacije atomske jezgre: povijest otkrića, glavne vrste transformacija
Radioaktivne transformacije atomske jezgre: povijest otkrića, glavne vrste transformacija Kako odrediti valenciju
Kako odrediti valenciju Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme
Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme Posterati Bore
Posterati Bore Proton naboj je osnovna vrijednost fizike elementarnih čestica
Proton naboj je osnovna vrijednost fizike elementarnih čestica Iskustvo Rutherforda
Iskustvo Rutherforda Otkriće protona i neutrona
Otkriće protona i neutrona Što su valentni elektroni?
Što su valentni elektroni? Rutherfordovi eksperimenti
Rutherfordovi eksperimenti Što je propadanje alfa?
Što je propadanje alfa? Energija ionizacije atoma
Energija ionizacije atoma Ukratko o kompleksu: struktura školjaka atoma elektrona
Ukratko o kompleksu: struktura školjaka atoma elektrona Struktura atomske jezgre: povijest studija i suvremena obilježja
Struktura atomske jezgre: povijest studija i suvremena obilježja Planetarni model atoma: teorijsko opravdanje i praktični dokazi
Planetarni model atoma: teorijsko opravdanje i praktični dokazi Što se sastoji od atoma bilo koje tvari?
Što se sastoji od atoma bilo koje tvari?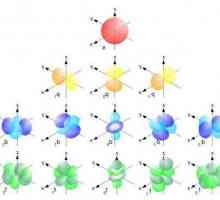 Elektronska konfiguracija - tajne strukture atoma
Elektronska konfiguracija - tajne strukture atoma
 Planetarni model Rutherforda, atom u modelu Rutherford
Planetarni model Rutherforda, atom u modelu Rutherford Struktura atoma. Kvantno-mehanički model atoma
Struktura atoma. Kvantno-mehanički model atoma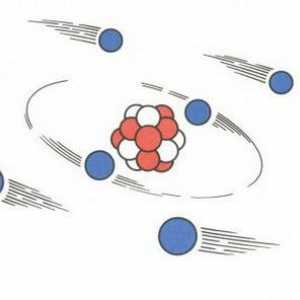 Razgovarajmo o tome kako pronaći protone, neutrone i elektrone
Razgovarajmo o tome kako pronaći protone, neutrone i elektrone Radioaktivne transformacije atomske jezgre: povijest otkrića, glavne vrste transformacija
Radioaktivne transformacije atomske jezgre: povijest otkrića, glavne vrste transformacija Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme
Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme