Razvrstavanje kemijskih reakcija
Kemijska reakcija je proces preobrazbe tvari, tijekom kojih se promatra promjena njihove strukture ili sastava. Kao rezultat ovog procesa, odvija se prijelaz polaznih materijala ili reagensa do konačnih proizvoda. Do danas je formirana vrlo jasna klasifikacija kemijskih reakcija.
sadržaj
Opis reakcija pomoću jednadžbi. Znakovi kemijskih reakcija
Postoji nekoliko klasifikacija, od kojih svaka uzima u obzir jednu ili više karakteristika. Na primjer, kemijske reakcije mogu se podijeliti, obraćajući pažnju na:
- količina i sastav reagensa i gotovih proizvoda;
- agregatno stanje početnih i konačnih tvari (plin, tekući, čvrsti oblik);
- broj faza;
- priroda čestica koje se prenose tijekom reakcije (ion, elektron);
- toplinski učinak;
- mogućnost reakcije u suprotnom smjeru.
Važno je napomenuti da su kemijske reakcije obično napisane pomoću formula i jednadžbi. Lijeva strana jednadžbe opisuje sastav reagensa i prirodu njihove interakcije, a na desnoj strani možete vidjeti konačne proizvode. Još jedna vrlo važna točka - broj atoma svakog elementa na desnoj i lijevoj strani bi trebao biti jednak. Samo se na taj način promatra zakon o očuvanju mase.
Kao što je već spomenuto, postoje mnoge klasifikacije. Ovdje ćete naći najčešće korištene.
Razvrstavanje kemijskih reakcija prema sastavu, količini inicijalnih i konačnih proizvoda
Reakcija spoja: u njih ulaze nekoliko tvari koje se kombiniraju kako bi nastale složenije tvari. U većini slučajeva, ova reakcija je praćena oslobađanjem topline.
Reakcije razgradnje: Inicijalni reagens je složeni spoj koji tijekom dekompozicije tvori nekoliko jednostavnijih tvari. Takve reakcije mogu biti obje redoksne reakcije i mogu se pojaviti bez promjene valencije.
Reakcije supstitucije su interakcija između kompleksa i jednostavne tvari. U tom se postupku zamjenjuje atom složene tvari. Shematski, reakcija se može prikazati na sljedeći način:
A + BC = AB + C
Razmjenjive reakcije su proces tijekom kojeg dva početna reagenta razmjenjuju sastavni dio. Na primjer:
AB + SD = AD + CB
Prijelazne reakcije karakterizirane su prijenosom atoma ili skupine atoma iz jedne supstance u drugu.
Razvrstavanje kemijskih reakcija: reverzibilni i nepovratni procesi
Druga važna karakteristika reakcija je mogućnost obrnutog procesa.
Dakle, reverzibilni se nazivaju takve reakcije, čiji proizvodi mogu međusobno komunicirati, stvarajući iste početne tvari. U pravilu, ta se značajka mora prikazati u jednadžbi. U ovom slučaju, dvije suprotno usmjerene strelice nalaze se između lijeve i desne strane jednadžbe.
Uz nepovratnu kemijsku reakciju, njegovi proizvodi ne mogu međusobno reagirati - barem u normalnim uvjetima.
Razvrstavanje kemijskih reakcija toplinskim učinkom
Termokemijske reakcije podijeljene su u dvije glavne skupine:
- egzotermni procesi, tijekom kojih dolazi do oslobađanja topline (energije);
- endotermnih procesa, za koje je potrebno apsorbirati energiju izvana.
Razvrstavanje kemijskih reakcija brojem faza i karakteristika faza
Kao što je već spomenuto, agregatno stanje tvari su također od velike važnosti za potpunu karakterizaciju kemijske reakcije. Na temelju tih razloga je uobičajeno razlikovati:
- plinske reakcije;
- reakcije u otopinama;
- kemijski procesi između krute tvari.
No, izvorni i konačni proizvodi ne odnose se uvijek na jednu agregatnu državu. Stoga se reakcije klasificiraju prema broju faza:
- jednorazne ili homogene reakcije su procesi čiji su proizvodi u istom stanju (u većini slučajeva ova reakcija odvija se bilo u plinskoj fazi ili u otopini);
- heterogene reakcije (višefazni) - reagensi i konačni produkti mogu biti u različitim agregatnim stanjima.
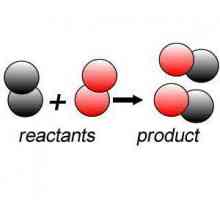 Reakcija spoja: primjeri i formula
Reakcija spoja: primjeri i formula Kemijska ravnoteža: konstanta kemijske ravnoteže i načine njezina izražavanja
Kemijska ravnoteža: konstanta kemijske ravnoteže i načine njezina izražavanja Reakcija spoja. Primjeri reakcije spoja
Reakcija spoja. Primjeri reakcije spoja Homogeni sustav
Homogeni sustav Homogene reakcije.
Homogene reakcije. Kako sastaviti kemijsku jednadžbu: pravila, primjeri. Zapisnik o kemijskoj reakciji
Kako sastaviti kemijsku jednadžbu: pravila, primjeri. Zapisnik o kemijskoj reakciji Kemijske jednadžbe: kako riješiti najučinkovitije
Kemijske jednadžbe: kako riješiti najučinkovitije Reakcija interakcije CaCl2, H2S04
Reakcija interakcije CaCl2, H2S04 Bit kemijske reakcije. Zakon o očuvanju masenih tvari (kemija)
Bit kemijske reakcije. Zakon o očuvanju masenih tvari (kemija) Kemijske reakcije: zašto su alkemičari u krivu
Kemijske reakcije: zašto su alkemičari u krivu Vrste kemijskih reakcija
Vrste kemijskih reakcija Kemijski fenomeni u svakodnevnom životu
Kemijski fenomeni u svakodnevnom životu Kakav je toplinski učinak reakcije
Kakav je toplinski učinak reakcije Aktivacijska energija
Aktivacijska energija Čimbenici koji utječu na brzinu kemijske reakcije
Čimbenici koji utječu na brzinu kemijske reakcije Reakcije koje se javljaju u neomomogenom mediju nazivaju se ... Vrste reakcija u kemiji
Reakcije koje se javljaju u neomomogenom mediju nazivaju se ... Vrste reakcija u kemiji Kemijska ravnoteža: kako je to pomaknuti
Kemijska ravnoteža: kako je to pomaknuti Što je katalitička reakcija? Osnovni principi i vrste
Što je katalitička reakcija? Osnovni principi i vrste Redoslijed reakcije: koncept, vrste
Redoslijed reakcije: koncept, vrste Kemijska ravnoteža temelj je reverzibilnih kemijskih reakcija
Kemijska ravnoteža temelj je reverzibilnih kemijskih reakcija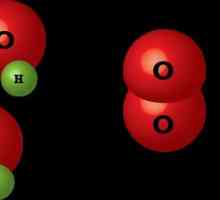 Kemijska reakcijska jednadžba - uvjetni rekord kemijske reakcije
Kemijska reakcijska jednadžba - uvjetni rekord kemijske reakcije
 Kemijska ravnoteža: konstanta kemijske ravnoteže i načine njezina izražavanja
Kemijska ravnoteža: konstanta kemijske ravnoteže i načine njezina izražavanja Reakcija spoja. Primjeri reakcije spoja
Reakcija spoja. Primjeri reakcije spoja Kako sastaviti kemijsku jednadžbu: pravila, primjeri. Zapisnik o kemijskoj reakciji
Kako sastaviti kemijsku jednadžbu: pravila, primjeri. Zapisnik o kemijskoj reakciji Kemijske jednadžbe: kako riješiti najučinkovitije
Kemijske jednadžbe: kako riješiti najučinkovitije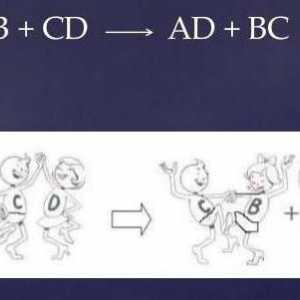 Reakcija interakcije CaCl2, H2S04
Reakcija interakcije CaCl2, H2S04 Bit kemijske reakcije. Zakon o očuvanju masenih tvari (kemija)
Bit kemijske reakcije. Zakon o očuvanju masenih tvari (kemija)