Glavne vrste kemijskih veza: zašto i kako se formiraju
Zakoni kojima tvari transformiraju dugo su ostale neriješeno otajstvo čovjeku. Klasičnu teoriju međatomskih veza predložila je vrlo kasno - 1916. Od tada se razvijaju pogledi znanstvenika. U principu ništa od toga nije otkriveno, a sada svaki učenik zna vrste kemijskih veza, koje barem pokušava naučiti. Za ovo znanje, neki srednjovjekovni znanstvenici prodali bi dušu.
sadržaj
Dakle, postoje osnovne vrste kemijskih veza i dodatnih, nazvanih slabe interakcije. Ponekad, međutim, postaju važni, na primjer, u formiranju strukture proteina. Osnovne vrste kemijske veze uključuju kovalentne, ali i ionske i metalne.
Počnimo s kovalentnim. Za njih je Gilbert Lewis predložio svoju prvu klasičnu teoriju kemijskog povezivanja. Koja je ideja ovog znanstvenika, do sada do sada? Kovalentna veza je formiran zato što se u vezanom obliku u sustavu atoma proizvodi manje energije nego u atomima jedan po jedan. A ovo je važno u kemiji. Svaki sustav nastoji riješiti maksimalnu količinu energije. Tijekom formiranja kovalentne veze, svaki od atoma koji kombiniraju doprinosi stvaranju spoja. Tako, vanjski elektroničku razinu Ispada da čestice s negativnim nabojem idu "u opću upotrebu".
Vrste kemijskih veza podijeljene su u podtipove. Na primjer, kovalentna veza često nije polarna - na primjer, između atoma identičnog kemijskog elementa. Tako se formiraju molekule plinova, kao što su dušik, fluor, vodik. Elektronički par "u zajedničkom vlasništvu" geometrijski je približno u sredini. Iako je to teško govoriti, jer istraživanje pokazuje da je gotovo nemoguće predvidjeti put jednog elektrona.
Druga stvar je veza između atoma različitih kemijskih elemenata. Na primjer, u vezi između fluora i vodikovih atoma, zajednička para je prostorno bliže jedan od atoma, naime - fluor. Ova veza ima polarno ime.
Ali ne uvijek atomi "iskreno pridonose jednako" u formiranju doprinosa. Također se događa da jedan od atoma daje dva elektrona odjednom, a druga - orbita za ovaj par, koja ide u opću upotrebu. Kako navesti prirodu ovog spoja? Vrsta priključka akceptora donatora. Amonijev ion može biti dobar primjer. Tri vodikova atoma uključeni su u uobičajenim polarnim kovalentne veze, a preostali slobodni par elektrona dušika mogu biti poslani u zajedničko korištenje s drugim atom vodika. Ipak, takva se veza smatra kovalentnom, jer se regije visoke gustoće elektrona nalaze između atoma.
Koje druge vrste kemijskih veza postoje? Postoji ionska veza između čestica koje imaju različite naboje. Sila privlačnosti elementi ove veze ovise samo o udaljenosti koja ih razdvaja i na orijentaciji - ne ovisi. Gdje se nalaze takve veze? Prije svega, u kristalnim supstancama - lužinama, karbidima, solima, nitrima, bazični oksidi. Ako su kation i anion slični po veličini, tada veza postaje osobito stabilna. Neki kemičari obično smatraju ovu vrstu veze kao ekstremni slučaj polarne kovalentnosti. No, ovo je kontroverzno pitanje, jer gustoća elektrona i dalje u potpunosti ne pristupa negativno nabijenom kationu.
Metalna veza obično je vrlo različita od drugih vrsta kemijskih veza. Zato što nije samo jedinstvena kemijska, već i jedinstvena fizička pojava. Činjenica je da elektroni formiraju sve atome u formiranju veze. A njihovo usmjereno gibanje objašnjava mogućnost velike električne vodljivosti u metalima. Tako svaki atom u području rešetke doprinosi kemijskoj vezi.
Kako je postalo jasno iz gore navedenog opisa, vrste kemijskih veza razlikuju se prema načelu njihove formiranja.
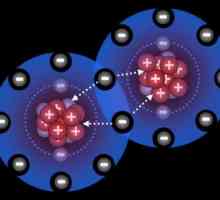 Donator-akceptorski mehanizam: primjeri. Što je mehanizam akceptora donatora?
Donator-akceptorski mehanizam: primjeri. Što je mehanizam akceptora donatora? Što je složena tvar? Kako se to događa?
Što je složena tvar? Kako se to događa?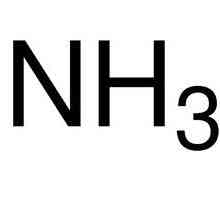 Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata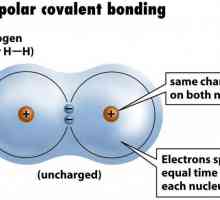 Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna
Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna Osnovne teze Butlerovove teorije AM Osnovne teze Butlerovove teorije kemijske strukture
Osnovne teze Butlerovove teorije AM Osnovne teze Butlerovove teorije kemijske strukture Donja-akceptorska veza: primjeri tvari
Donja-akceptorska veza: primjeri tvari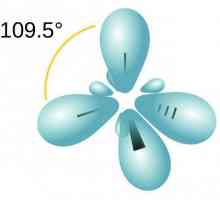 Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije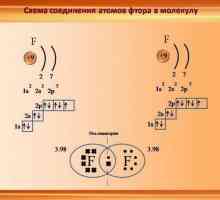 Karakteristike kovalentne veze. Za one tvari je kovalentna veza
Karakteristike kovalentne veze. Za one tvari je kovalentna veza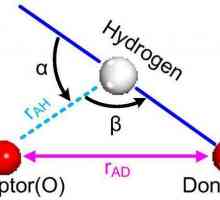 Vodikova veza: primjeri i vrste kemijskih veza
Vodikova veza: primjeri i vrste kemijskih veza Vrste kemijskih reakcija
Vrste kemijskih reakcija Kovalentna veza
Kovalentna veza Što je vodikova veza? Vrste, utjecaj
Što je vodikova veza? Vrste, utjecaj Ionska kristalna rešetka
Ionska kristalna rešetka Što je kovalentna polarna veza
Što je kovalentna polarna veza Metalno lijepljenje
Metalno lijepljenje Ion vezivanje
Ion vezivanje Značajke strukture atoma metala
Značajke strukture atoma metala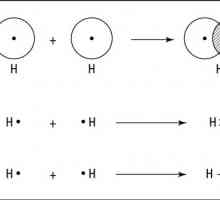 Predmet i zadaci kemije. Opća kemija. Organska kemija
Predmet i zadaci kemije. Opća kemija. Organska kemija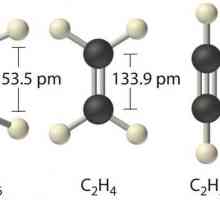 Kemijska veza: definicija, vrste, klasifikacija i značajke definicije
Kemijska veza: definicija, vrste, klasifikacija i značajke definicije Kemijski element je vrsta atoma s istim nuklearnim nabojem
Kemijski element je vrsta atoma s istim nuklearnim nabojem Kovalentna nepolarna veza je kemijska veza koju čine identični atomi
Kovalentna nepolarna veza je kemijska veza koju čine identični atomi
 Što je složena tvar? Kako se to događa?
Što je složena tvar? Kako se to događa? Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata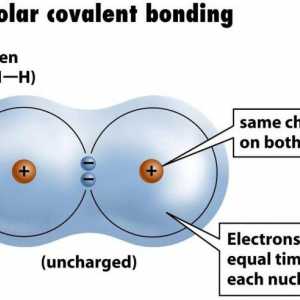 Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna
Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna Osnovne teze Butlerovove teorije AM Osnovne teze Butlerovove teorije kemijske strukture
Osnovne teze Butlerovove teorije AM Osnovne teze Butlerovove teorije kemijske strukture Donja-akceptorska veza: primjeri tvari
Donja-akceptorska veza: primjeri tvari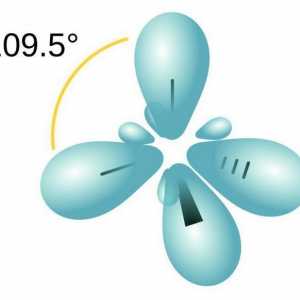 Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije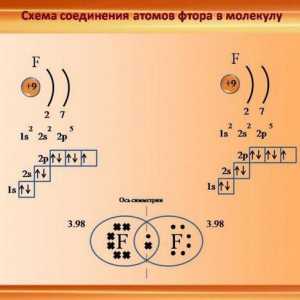 Karakteristike kovalentne veze. Za one tvari je kovalentna veza
Karakteristike kovalentne veze. Za one tvari je kovalentna veza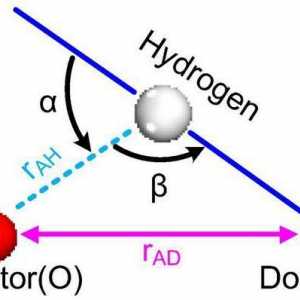 Vodikova veza: primjeri i vrste kemijskih veza
Vodikova veza: primjeri i vrste kemijskih veza