Alotropija je ... Definicija pojma i uzroka
Iz našeg članka saznat ćete, što je alotropija.
sadržaj
Definicija koncepta
Alotropija se odnosi na fenomen postojanja jednog kemijskog elementa u obliku dviju ili više jednostavnih tvari. Njegova je otkrića s pravom smatra kemičarom i minerologom iz Švedske Jensom Berzeliusom. Alotropija je fenomen koji ima mnogo zajedničkog s polimorfizmom kristala. To je izazvalo mnoge kontroverze među znanstvenicima. Trenutno su došli do zaključka da je polimorfizam karakterističan samo za krute jednostavne tvari.
Uzroci alotropije
Formiranje nekoliko jednostavnih tvari možda nije sve kemijske elemente. Sposobnost alotropije je zbog strukture atoma. Najčešće se događa u elementima koji imaju promjenjivi stupanj oksidacije. To uključuje polu- i nemetale, inertne plinove i halogene.
Alotropija može biti posljedica nekoliko razloga. To uključuje različite broj atoma, red njihovog povezivanja s molekulom, paralelizam elektronskih vrhova, vrsta kristalne rešetke. Razmotrite ove vrste alotropija na specifične primjere.

Kisik i ozon
Ova vrsta allotropije je primjer kako drugačiji broj atoma jednog kemijskog elementa određuje fizičku i kemijsku svojstva tvari. To se također odnosi i na fiziološke učinke na žive organizme. Dakle, kisik se sastoji od dva atoma kisika, ozona od tri.
Koje su razlike između tih tvari? Obje su plinovite. Kisik nema boju, okus i miris, to je jedan i pol puta lakši od ozona. Ova tvar je visoko topljiva u vodi, a uz smanjenje temperature, brzina ovog procesa samo se povećava. Kisik je potreban za sve organizme za disanje. Stoga je ta supstanca od vitalne važnosti.
Ozon je plava. Svaki od nas osjetio je karakterističan miris nakon kiše. Oštra, ali prilično lijepa. U usporedbi s kisikom, ozon je kemijski aktivniji. Koji je razlog? Tijekom raspada ozona nastaju molekule kisika i slobodni kisikov atom. On odmah ulazi reakcija spoja, stvaranje novih tvari.
Iznenađujuće svojstva ugljika
Ali broj atoma u molekuli ugljika uvijek ostaje nepromijenjen. Štoviše, ona tvore apsolutno različite supstance. Najčešći modifikacija ugljika su dijamant i grafit. Prva tvar smatra se najtežim na planeti. Ova imovina je zbog činjenice da atomi u dijamantu vežu snažne kovalentne veze u svim smjerovima. Zajedno čine trodimenzionalnu mrežu tetraedara.

Kod grafita, jake veze formiraju se samo između atoma smještenih u vodoravnoj ravnini. Zbog toga je prakticno nemoguce razbiti grafitnu šipku. No, veze koje povezuju vodoravne slojeve ugljika između sebe su vrlo slabe. Stoga, svaki put kada držimo olovku na papiru, na njoj ostaje sivi trag. Ovo je sloj ugljika.
Alotropija sumpora
Razlog za modificiranje sumpora također leži u osobitostima unutarnje strukture molekula. Najstabilniji oblik je rombo. Kristali ove vrste sumporne alotrope nazivaju se romboidni. Svaki od njih formiraju krunske molekule, od kojih svaka sadrži 8 atoma. Prema fizikalnim svojstvima, sumporni sumpor je žuta krutina. Ne samo da se ne otapa u vodi, već i ne mokri. Parametri toplinske i električne provodljivosti su vrlo niski.

Struktura monoklinskog sumpora je paralelopiped s kosim kutovima. Vizualno, ta tvar nalikuje iglu tamno žute boje. Ako se sumpor rastopi i zatim stavi u hladnu vodu, nastaje nova modifikacija. Njezina izvorna struktura kolabira se na polimerne lance različitih duljina. Tako dobiju plastični sumpor - gumenu masu smeđe boje.
Promjene fosfora
Znanstvenici imaju 11 vrsta fosfora. Njegova je alotropija otkrivena gotovo slučajno, kao i sama tvar. U potrazi za filozofskim kamenom, alkemičar Brand je dobio isparljivu suhu tvar kao rezultat isparavanja urina. Bio je to bijeli fosfor. Ova tvar karakterizira velika kemijska aktivnost. Dovoljno je podići temperaturu do 40 stupnjeva, tako da bijeli fosfor reagira s kisikom i zapali.

Za fosfor, uzrok alotropije je promjena u strukturi kristalne rešetke. Možete ga mijenjati samo pod određenim uvjetima. Dakle, povećavajući tlak i temperaturu u atmosferi ugljičnog dioksida, dobije se crveni fosfor. Kemijski je manje aktivan, pa nije tipičan za sjaj. Kada se zagrije, pretvara se u paru. Svaki put to gledamo, osvjetljavajući uobičajene utakmice. Površina površine sadrži crveni fosfor.
Dakle, allotropija je postojanje jednog kemijskog elementa u obliku nekoliko jednostavnih tvari. Najčešće se nalaze među nonmetals. Glavni razlozi ovog fenomena su različiti brojevi atoma koji tvore molekulu tvari, kao i promjena u konfiguraciji kristalne rešetke.
 Što je složena tvar? Kako se to događa?
Što je složena tvar? Kako se to događa?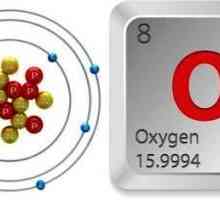 Alotropne modifikacije kisika: komparativna svojstva i vrijednost
Alotropne modifikacije kisika: komparativna svojstva i vrijednost Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata Molarna masa kisika. Koja je molarnu masu kisika?
Molarna masa kisika. Koja je molarnu masu kisika?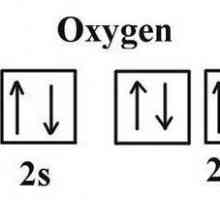 Koja je kisika kisika u spojevima?
Koja je kisika kisika u spojevima? Ozon (kemijski element): svojstva, formula, oznaka
Ozon (kemijski element): svojstva, formula, oznaka Koji je stupanj oksidacije kisika? Valencija i stupanj oksidacije kisika
Koji je stupanj oksidacije kisika? Valencija i stupanj oksidacije kisika Anorganske tvari
Anorganske tvari Koja je priroda oksida
Koja je priroda oksida Pronalaženje kisika u prirodi. Ciklus kisika u prirodi
Pronalaženje kisika u prirodi. Ciklus kisika u prirodi Kemijski element Francuske: karakteristike i povijest otkrića
Kemijski element Francuske: karakteristike i povijest otkrića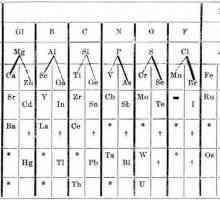 Periodni Mendelejev sustav i periodički zakon
Periodni Mendelejev sustav i periodički zakon Nemetali su ...? Svojstva ne-metala
Nemetali su ...? Svojstva ne-metala Kako odrediti stupanj oksidacije
Kako odrediti stupanj oksidacije Kako pronaći molarnu masu
Kako pronaći molarnu masu Alotropne modifikacije fosfora: svojstva i svojstva
Alotropne modifikacije fosfora: svojstva i svojstva Jednostavne tvari
Jednostavne tvari Alotropne modifikacije
Alotropne modifikacije Složene veze. Definicija, klasifikacija
Složene veze. Definicija, klasifikacija Kemijski element je vrsta atoma s istim nuklearnim nabojem
Kemijski element je vrsta atoma s istim nuklearnim nabojem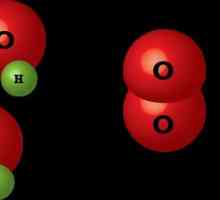 Kemijska reakcijska jednadžba - uvjetni rekord kemijske reakcije
Kemijska reakcijska jednadžba - uvjetni rekord kemijske reakcije
 Alotropne modifikacije kisika: komparativna svojstva i vrijednost
Alotropne modifikacije kisika: komparativna svojstva i vrijednost Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata Molarna masa kisika. Koja je molarnu masu kisika?
Molarna masa kisika. Koja je molarnu masu kisika?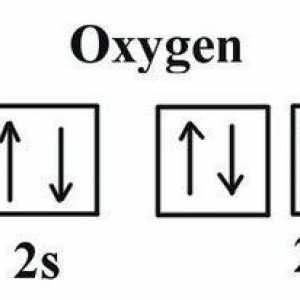 Koja je kisika kisika u spojevima?
Koja je kisika kisika u spojevima? Ozon (kemijski element): svojstva, formula, oznaka
Ozon (kemijski element): svojstva, formula, oznaka Koji je stupanj oksidacije kisika? Valencija i stupanj oksidacije kisika
Koji je stupanj oksidacije kisika? Valencija i stupanj oksidacije kisika Koja je priroda oksida
Koja je priroda oksida Pronalaženje kisika u prirodi. Ciklus kisika u prirodi
Pronalaženje kisika u prirodi. Ciklus kisika u prirodi Kemijski element Francuske: karakteristike i povijest otkrića
Kemijski element Francuske: karakteristike i povijest otkrića