Galvanski element: shema, načelo djelovanja, primjena
Da bi se izradila shema galvanske stanice, potrebno je razumjeti načelo njezina djelovanja, značajke strukture.
sadržaj
Potrošači rijetko posvećuju pozornost na baterije i baterije, dok su ti izvori struje najviše traženi.

Kemijski izvori struje
Što je galvanska stanica? Njegova se shema temelji na elektrolitu. Uređaj uključuje mali spremnik, gdje se nalazi elektrolit, adsorbiran materijalom za odvajanje. Osim toga, shema dviju galvanskih stanica pretpostavlja prisutnost katoda i anode. Kakvo je ime takve galvanske stanice? Krug koji povezuje dva metala zajedno pretpostavlja prisutnost reakcije smanjenja oksidacije.

Najjednostavnija galvanska stanica
To podrazumijeva prisutnost dva tanjura ili šipke od različitih metala, koji su uronjeni u otopinu jakog elektrolita. Tijekom rada ove galvanske ćelije provodi se oksidacijski proces na anodu, koji je povezan s oslobađanjem elektrona.
Na katodi, oporavak popraćen usvajanjem negativnih čestica. Postoji prijenos elektrona duž vanjskog kruga na oksidant iz redukcijskog sredstva.
Primjer galvanske stanice
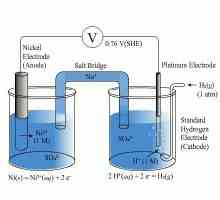
Kako bi se sastavili elektronički krugovi galvanskih ćelija, potrebno je znati vrijednost njihovog standardnog elektrodnog potencijala. Analizirajmo varijantu bakro-cincke galvanske stanice, koja funkcionira na temelju energije oslobođene tijekom interakcije bakrenog sulfata s cinkom.
Ova galvanska stanica, čija će shema biti dano u nastavku, zove se Jacobi-Danielov element. To uključuje bakar ploču, koji se uranja u otopinu bakar sulfata (bakar elektroda), a sastoji se od cinkove ploče, koji se nalazi u otopini sulfat (cinka elektroda). Rješenja su u kontaktu međusobno, ali da bi se spriječio njihovo miješanje, element koristi particiju od poroznog materijala.

Načelo rada
Kako funkcionira galvansko ćelija, čiji je krug oblik Zn? frac12- ZnSO4 frac12-frac12- CuSO4 frac12-Cu? Tijekom rada, kada je strujni krug zatvoren, dolazi do oksidacije metalnog cinka.
Na svojoj površini kontakta s otopinom soli, promatrana je pretvorba atoma u katione Zn2 +. Proces je praćen otpuštanjem "slobodnih" elektrona koji se kreću duž vanjskog kruga.
Reakcija na cinkovoj elektrodi može se prikazati u sljedećem obliku:
Zn = Zn2 + + 2e;
Smanjenje metalnih kationa provodi se na bakrenoj elektrodi. Negativne čestice koje dolaze ovdje iz cinka elektrode kombiniraju se s bakrenim kationima, istaložujući ih u obliku metala. Ovaj proces ima sljedeći oblik:
Cu2 + + 2e- = Cu
Ako kombinemo dvije reakcije koje su gore diskutirane, dobivamo sažetak jednadžbu koja opisuje rad cink-bakrene galvanske stanice.
Cinkova elektroda djeluje kao anoda, bakar služi kao katoda. Moderne galvanske ćelije i baterije pretpostavljaju korištenje jednog rješenja elektrolita, koja proširuje opseg primjene, čini njihov rad udobnijim i praktičnijim.

Vrste galvanskih stanica
Najčešći su elementi ugljena i cinka. Oni koriste pasivnu struju kolektora ugljika u kontaktu s anodom, što je manganski oksid (4). Elektrolit je amonijev klorid, koji se koristi u tijestom paste.
Ne širi, tako da se sama galvanska stanica naziva suhom. Njegova osobitost je mogućnost "oporavka" tijekom rada, što pozitivno utječe na trajanje njihovog operativnog razdoblja. Takve galvanske stanice su niske cijene, ali niske snage. Kada se temperatura smanjuje, oni smanjuju njihovu učinkovitost, a kada se povećava, elektrolit se postepeno isušuje.
Alkalni elementi pretpostavljaju upotrebu alkalijskih otopina, tako da imaju dosta primjena.
U litijskim ćelijama, aktivni metal djeluje kao anoda, što ima pozitivan učinak na životni vijek. Litij je negativan elektrodni potencijal, stoga u malim dimenzijama takvi elementi imaju najveći nazivni napon. Među nedostacima takvih sustava je visoka cijena. Otvaranje izvora struje od litija je eksplozivan.
zaključak
Načelo rada bilo koje galvanske stanice temelji se na procesima redukcije oksidacije koji se odvijaju na katodi i anodu. Ovisno o upotrijebljenom metalu, izabrana otopina elektrolita, vijek trajanja elementa varira, kao i vrijednost nazivnog napona. Za sada su potrebne litijske, kadmijske stanice, koje imaju prilično dug životni vijek.
 Koji je elektrodni potencijal?
Koji je elektrodni potencijal? Katoda i anoda - jedinstvo i borba suprotnosti
Katoda i anoda - jedinstvo i borba suprotnosti Unutarnji otpor trenutnog izvora. Otpor je formula
Unutarnji otpor trenutnog izvora. Otpor je formula Galvanska kupka s rukama. Obrada i grijanje galvanskih kupki
Galvanska kupka s rukama. Obrada i grijanje galvanskih kupki Mogu li napuniti alkalne baterije? Koja je razlika između soli i alkalnih baterija
Mogu li napuniti alkalne baterije? Koja je razlika između soli i alkalnih baterija Razvrstavanje, vrste i veličine baterija
Razvrstavanje, vrste i veličine baterija Elektroliza otopina: opis, primjena
Elektroliza otopina: opis, primjena Što je elektroliza? Anoda i katoda. Fizikalno-kemijski proces
Što je elektroliza? Anoda i katoda. Fizikalno-kemijski proces Plastifikacija u kući je njezina najvažnija komponenta
Plastifikacija u kući je njezina najvažnija komponenta Napunite krug akumulatora i načelo rada
Napunite krug akumulatora i načelo rada Anoda i katoda - što je to i kako točno odrediti?
Anoda i katoda - što je to i kako točno odrediti? Galvansko pocinčavanje metala: tehnologija, oprema
Galvansko pocinčavanje metala: tehnologija, oprema Punjive baterije: uređaj, rad, princip rada i krug
Punjive baterije: uređaj, rad, princip rada i krug Izvori struje su kemijski. Vrste kemijskih izvora struje i njihovog uređaja
Izvori struje su kemijski. Vrste kemijskih izvora struje i njihovog uređaja Koja je shema elektroničke bilance?
Koja je shema elektroničke bilance?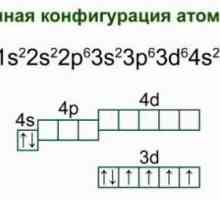 Željezo: struktura atoma, shema i primjeri. Elektronička struktura željezovog atoma
Željezo: struktura atoma, shema i primjeri. Elektronička struktura željezovog atoma Najšira primjena elektrolize
Najšira primjena elektrolize Elektrokemijska korozija
Elektrokemijska korozija Galvanski elementi: princip djelovanja i sorti
Galvanski elementi: princip djelovanja i sorti Stalna struja u ljudskom životu
Stalna struja u ljudskom životu Zašto nam je potrebna galvanska izolacija?
Zašto nam je potrebna galvanska izolacija?
 Katoda i anoda - jedinstvo i borba suprotnosti
Katoda i anoda - jedinstvo i borba suprotnosti Unutarnji otpor trenutnog izvora. Otpor je formula
Unutarnji otpor trenutnog izvora. Otpor je formula Galvanska kupka s rukama. Obrada i grijanje galvanskih kupki
Galvanska kupka s rukama. Obrada i grijanje galvanskih kupki Mogu li napuniti alkalne baterije? Koja je razlika između soli i alkalnih baterija
Mogu li napuniti alkalne baterije? Koja je razlika između soli i alkalnih baterija Razvrstavanje, vrste i veličine baterija
Razvrstavanje, vrste i veličine baterija Što je elektroliza? Anoda i katoda. Fizikalno-kemijski proces
Što je elektroliza? Anoda i katoda. Fizikalno-kemijski proces Napunite krug akumulatora i načelo rada
Napunite krug akumulatora i načelo rada Anoda i katoda - što je to i kako točno odrediti?
Anoda i katoda - što je to i kako točno odrediti?