Donja-akceptorska veza: primjeri tvari
Lijepljenje ili koordinacija primatelja donora je neka vrsta kovalentne veze. Otkrivamo istaknute značajke ove vrste povezanosti, dajemo primjere koji pokazuju njegovo stvaranje.
sadržaj

Kovalentna veza
Za početak odabiremo osobitosti najviše kovalentne kemijske veze.
Može biti polarna i nepolarna, ovisno o položaju elektronskog para između atoma. Ako se djelomični pomak gustoće elektrona odvija prema jednom od atoma, kovalentni polarni kemijska veza. Sličan je fenomen moguć uz stvaranje veze između nemetala koji imaju različitu elektronsku zastupljenost. Kada se povećava, dolazi do značajnog pomaka elektronskog para prema atomu s velikim EO eksponentom. Kada se stvori veza između nemetala koji imaju istu elektronegativnost, ne postoji pomak para elektrona, takva se veza naziva nepolarna.
Primjeri su kisik, vodik, ozon, fosfor. Polarna veza je klorovodična kiselina, voda, amonijak.
Postoji poseban termin kojim se karakterizira broj parova elektrona koji nastaju između atoma.
S obzirom na to da su dva elektrona potrebna za formiranje jedne veze, bit će tri veza između atoma dušika, to jest, mnoštvo odgovara tri. Prihvaćanje donorsko-akceptora je poseban slučaj kovalentne polarne veze, ali pretpostavlja se intermolekularna interakcija tvari.

Značajke mehanizma
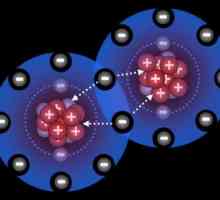
Da bi se stvorila obična kovalentna veza, dovoljno je imati interakciju između dva elektrona (od zajedničkog para). Donor-akceptor veza formirana kemikalije kroz par elektrona s jedne strane (od donora), prazna (slobodno) u orbitalni drugog atoma (akceptor). U slučaju kovalentna polarna (nepolarna) veza i u interakciji donator-akceptor, elektroni se na kraju postaju uobičajeni.

Formiranje amonijevog kationa
Kako se formira donorsko-akceptorska veza? Primjeri tvari koje se daju tijekom kemije srednje škole ograničene su na amonijev kation. Razmotrimo njegovo obrazovanje detaljnije.
Dušik, koji je dio molekule amonijaka, nalazi se u petoj skupini (glavnoj podskupini) periodičkog stola. Na vanjskom razina energije postoji pet elektrona. U stvaranju molekule amonijaka u polarnom kovalentne veze dušik provodi tri elektrona, tako da je elektronski par, koji nije uključen u takvom postupku, ostaje neiskorišten.
Ona mu daje pravo da očituje svojstva donatora kada molekule amonijaka dolaze zajedno s vodenim dipolama. U vodi vodikov kation nema vlastite elektrone, pa pokazuje svojstva akceptora.
U trenutku kada je molekula amonijaka dovoljno blizu vodikovih protona iz vode, oblak dušik koji se sastoji od dva elektrona pretvara u privlačnost vodika kationom, postaje zajedničko im. Rezultat je tvorba tetravalentni veza između dušika i vodika, pretpostavlja davaoc-primaoc mehanizam. Ovo, kao što kažu, klasičan je primjer oblikovanja komunikacije.
Oblikovanje oksonijskog kationa
U školskom kurikulumu (osnovna razina) ne smatra Oksonijev kationi (hydronium), kao Protolytic teorija rješenja je studirao samo na razini profila. Budući da se ovdje koristi i donorsko-akceptorska veza, detaljnije će se razmotriti primjeri njegovog formiranja.
Kao donator u ovom slučaju će djelovati molekula vode, a proton pokazuje svojstva akceptora. Razmatrani mehanizam akceptora donatora je ono što se zove temelj kemije složenih spojeva, pa stoga zaslužuje posebnu pažnju. On objašnjava bit teorije elektrolitičke razgradnje kiselina, soli, baza kada se otopi u vodi u katione i anione.
Kada takva veza bude prisiljena, dolazi do penetracije vezanih elektrona u vanjsku ljusku atoma vezanih na njih. U ovom slučaju, povećanje broja elektrona na vanjskim školjkama povećava se za jedan.

Drugi algoritam komunikacije
Postoji još jedan mehanizam kojim se formira donorsko-akceptorska veza. Primjeri takvih interakcija su brojni, posebice stvaranje metalnih fluorida. Primjećuje se par elektrona jednog od atoma koji reagiraju. Kao rezultat toga, jedan atom dovršava svoju ljusku na maksimum, ali ne svi osam elektrona sudjeluju u vezi, samo određeni dio njih. Oni elektroni koji neće sudjelovati u vezi se zovu slobodni, a uz pomoć drugih, stvara se obveznica darivatelja i primatelja. Primjeri takve inačice donorsko-akceptorske veze odnose se na stvaranje fluorida alkalnih i zemno alkalijskih metala. Na primjer, natrij, kalij, kalcij fluorid je slično pripremljen.
Koja je razlika između obveznice donatora i akceptora? Moguće je izdvojiti stabilne spojeve koji nastaju uslijed sličnog mehanizma za stvaranje kemijskih spojeva. Na primjer, otapanje vodikovog fluorida u vodi, veza između amonijaka i aluminijevog klorida, što dovodi do stvaranja složenih spojeva.

zaključak
Uzimajući u obzir pravila interakcije donator-akceptor, to imamo na umu inertnih plinova mogu djelovati kao aktivni donatori, budući da imaju najveći broj elektrona na vanjskoj ljusci. Eksperimentalno je takva izjava u potpunosti potvrđena i otkriveni su oksidi inertnih plinova koji su stvoreni upravo zahvaljujući interakciji akceptora donatora.
Ova vrsta kovalentne veze ima poseban značaj u ljudskom životu. Uz aktivno sudjelovanje u životu, zahvaljujući komunikaciji primatelja i donatora, moguće je stvoriti prehrambene proizvode, različite farmaceutske pripravke. Na primjer, mehanizam formiranja amonijskog kationa, koji je gore razmatran, odnosi se na formiranje amonijaka, koji se široko koristi u modernoj medicini.
 Donator-akceptorski mehanizam: primjeri. Što je mehanizam akceptora donatora?
Donator-akceptorski mehanizam: primjeri. Što je mehanizam akceptora donatora?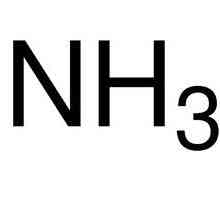 Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata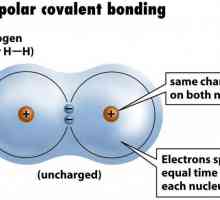 Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna
Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna Elektrofilno dodavanje u organskoj kemiji
Elektrofilno dodavanje u organskoj kemiji Kako odrediti stupanj oksidacije
Kako odrediti stupanj oksidacije Kako odrediti valenciju
Kako odrediti valenciju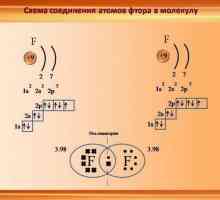 Karakteristike kovalentne veze. Za one tvari je kovalentna veza
Karakteristike kovalentne veze. Za one tvari je kovalentna veza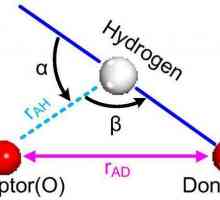 Vodikova veza: primjeri i vrste kemijskih veza
Vodikova veza: primjeri i vrste kemijskih veza Glavne vrste kemijskih veza: zašto i kako se formiraju
Glavne vrste kemijskih veza: zašto i kako se formiraju Kovalentna veza
Kovalentna veza Dielektrika u električnom polju
Dielektrika u električnom polju Što je vodikova veza? Vrste, utjecaj
Što je vodikova veza? Vrste, utjecaj Kristalna rešetka i glavni tipovi
Kristalna rešetka i glavni tipovi Što je kovalentna polarna veza
Što je kovalentna polarna veza Metalno lijepljenje
Metalno lijepljenje Ion vezivanje
Ion vezivanje Energija ionizacije atoma
Energija ionizacije atoma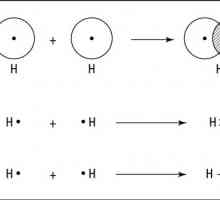 Predmet i zadaci kemije. Opća kemija. Organska kemija
Predmet i zadaci kemije. Opća kemija. Organska kemija Strukturna formula je grafički prikaz tvari
Strukturna formula je grafički prikaz tvari Kemijska veza: definicija, vrste, klasifikacija i značajke definicije
Kemijska veza: definicija, vrste, klasifikacija i značajke definicije Kovalentna nepolarna veza je kemijska veza koju čine identični atomi
Kovalentna nepolarna veza je kemijska veza koju čine identični atomi
 Odredite valenciju kemijskih elemenata
Odredite valenciju kemijskih elemenata Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna
Primjer nepolarne kovalentne veze. Kovalentna veza polarna i nepolarna Elektrofilno dodavanje u organskoj kemiji
Elektrofilno dodavanje u organskoj kemiji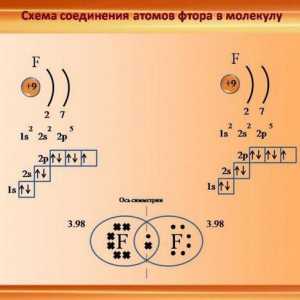 Karakteristike kovalentne veze. Za one tvari je kovalentna veza
Karakteristike kovalentne veze. Za one tvari je kovalentna veza Vodikova veza: primjeri i vrste kemijskih veza
Vodikova veza: primjeri i vrste kemijskih veza