Hidracija propilena: reakcijska jednadžba
Organska pitanja zauzimaju važno mjesto u našem životu. Oni su glavni sastojak polimera koji nas okružuju posvuda: to su plastične vrećice, guma, kao i mnogi drugi materijali. Polipropilen nije posljednji korak u ovoj seriji. Također je dio raznih materijala i koristi se u brojnim industrijama, kao što je konstrukcija, ima kućnu upotrebu kao materijal za plastične čaše i druge male (ali ne i za proizvodnu skalu). Prije nego što govorimo o procesu poput hidratacije propilena (zahvaljujući čemu, usput, možemo dobiti izopropil alkohol),
sadržaj

priča
Kao takav, datum otkrića nema propilen. Međutim, njegov polimer, polipropilen, zapravo je otkrio 1936. godine poznati njemački kemičar Otto Bayer. Naravno, bilo je teoretski poznato kako se može dobiti takav važan materijal, ali praktički to nije bilo moguće učiniti. To je uspio samo u sredinom dvadesetog stoljeća kada je njemački i talijanski kemičara i Ziegler Nutt otvorio nezasićeni ugljikovodik polimerizacije katalizator (koji ima jednu ili više dvostrukih veza), koji je kasnije i pod nazivima: Ziegler-Natta katalizatora. Do ove točke, bilo je apsolutno nemoguće napraviti reakciju polimerizacije takvih tvari. Reakcije polikondenzacije bile su poznate, gdje se, bez djelovanja katalizatora, tvari kombiniraju u polimerni lanac i time stvaraju nusprodukt. Ali s nezasićenih ugljikovodika to se nije moglo učiniti.
Drugi važan proces povezan s tom tvari bio je njegova hidratacija. Propilen u godinama njene primjene bio je dosta. I sve to zahvaljujući izumima raznih tvrtki za preradu nafte i plina načinima stvrdnjavanja propena (to se ponekad naziva i opisana supstancija). Pucketanje sirove nafte bila je nusproizvod, a kad se ispostavilo da je njegov derivat, izopropil alkohol, je osnova za sintezu mnogih korisnih tvari za čovječanstvo, mnoge tvrtke, kao što su BASF, patentirao svoju metodu proizvodnje i pokrenula veliku trgovinu s tim u vezi. Hidratiranje propilena je ispitano i primijenjeno prije polimerizacije, zbog čega je prije polipropilena počelo proizvoditi aceton, vodikov peroksid, izopropilamin.

Proces odvajanja propena od nafte je vrlo zanimljiv. Njemu se sada okrećemo.
Izolacija propilena
Zapravo, u teorijskom tumačenju, glavna metoda je samo jedan proces: piroliza ulja i povezanih plinova. Ali tehnološke realizacije su samo more. Činjenica je da svaka tvrtka nastoji dobiti jedinstven način i zaštititi njegov patent i druge slične tvrtke su također u potrazi za vlastite načine kako dalje napraviti i prodati propen kao sirovina ili pretvoriti ga u raznim proizvodima.
Pirolize ( „Pyro” - vatra „Liz” - uništenje) - kemijski propadanja proces kompliciran i velikih molekula u manje pod utjecajem visoke temperature i katalizatora. Ulje, kao što je poznato, je smjesa ugljikovodika i sastoji se od laganih, srednjih i teških frakcija. Od prve, najniže molekularne molekule, i dobiti propen i etan u pirolizu. Provesti ovaj proces u posebnim pećnicama. U najnaprednijim proizvođačima procesne tehnologije razlikuje: neki pijesak se koristi kao rashladno sredstvo, s druge - kvarca i drugih - također može podijeliti koks- peć u svojoj strukturi: postoje cjevasti i konvencionalni, kao što su oni nazivaju reaktora.
Ali proces pirolize omogućava dobivanje nedovoljno čistog propena, budući da se pored toga formiraju veliki broj ugljikovodika koji se zatim moraju razdvojiti metodama koje troše energiju. Stoga, za dobivanje čistije tvari za naknadnu hidrataciju, također se koristi dehidrogenacija alkana: u našem slučaju propana. Baš kao i polimerizacija, gore navedeni proces jednostavno se ne događa. Odvajanje vodika od molibijaka krajnjeg ugljikovodika javlja se pod utjecajem katalizatora: oksid trovalentnog kroma i aluminijevog oksida.
Pa, prije nego što se priča o procesu hidratacije, pogledajmo strukturu našeg nezasićenog ugljikovodika.

Značajke strukture propilena
Sam propen je samo drugi član niz alkena (ugljikovodici s jednom dvostrukom vezom). Svojom lakoćom drugi je samo etilen (od kojeg, kao što možda mislite, napravljen je polietilen - najveći masovni polimer na svijetu). U uobičajenom stanju, propenski plin, kao i njegov "relativni" iz alkanske obitelji, je propan.
Ali bitna razlika između propana i propena je ta da potonji ima dvostruku vezu u svom sastavu, što temeljno mijenja kemijska svojstva. To omogućuje vezu molekule nezasićenih ugljikovodika drugih tvari, pri čemu se dobije spoj s potpuno različitim svojstvima je često vrlo važno za industriju i domaćinstvo.
Vrijeme je da razgovaramo o teoriji reakcije, što zapravo pripada ovom članku. U sljedećem odjeljku saznat ćete da se prilikom hidratacije propilena stvara jedan od najvažnijih industrijski važnih proizvoda, kao i način na koji se ova reakcija događa i koje su nijanse.

Teorija hidratacije
Prvo, pretvorimo se u općenitije proces - solvataciju - koja također uključuje gore opisanu reakciju. Ova kemijska transformacija, koja se sastoji od lijepljenja molekula otapala molekulama otopljene tvari. U tom slučaju mogu formirati nove molekule ili tzv. Solvate, - čestice koje se sastoje od molekula otopljene tvari i otapala, povezane elektrostatskom interakcijom. Samo smo zainteresirani za prvu vrstu tvari, zapravo, kada hidriraju propilen, to je uglavnom ovaj proizvod koji se formira.
Kada se solvatira na način opisan gore, molekule otapala su vezane na otopljenu tvar, dobiva se novi spoj. U organskoj kemiji hidrati uglavnom proizvode alkohole, ketone i aldehide, ali postoji nekoliko drugih slučajeva, na primjer, formiranje glikola, ali ih nećemo dirati. Zapravo, ovaj proces je vrlo jednostavan, ali istodobno je prilično složen.

Mehanizam hidratacije
Dvostruka veza, kao što je poznato, sastoji se od dvije vrste atoma za miješanje: pi i sigma veze. Pi-veza u reakciji hidratacije uvijek je najprije razbijena, jer je manje jaka (ima nižu energiju vezanja). Kada se prekine, formiraju se dva slobodna orbita na dva susjedna ugljikova atoma, koja mogu formirati nove veze. Vodena molekula koja postoji u otopini u obliku dviju čestica: hidroksidni ion i proton, sposobna je spojiti preko slomljene dvostruke veze. U tom slučaju, ion hidroksida je vezan na središnji atom ugljika, a proton na drugi, ekstrem. Tako se kod hidratacije propena pretežno formiraju propanol 1 ili izopropilni alkohol. Ovo je vrlo važna tvar, jer kad se oksidira, možete dobiti aceton koji se masivno koristi u našem svijetu. Rekli smo da je formirana uglavnom, ali to baš i nije tako. Moram to reći: jedini proizvod nastaje kada hidrira propilen, a to je izopropil alkohol.
Ovo, naravno, sve suptilnosti. Zapravo, sve se može opisati puno lakše. A sada saznajemo kako školski tečaj bilježi proces, kao što je hidratacija propilena.
Reakcija: kako se to događa
U kemiji, sve se obično naziva jednostavno: uz pomoć reakcijskih jednadžbi. Na taj način se može opisati kemijska transformacija tvari koja se raspravlja. Hidratiranje propilena, reakcijska jednadžba što je vrlo jednostavno, prolazi u dvije faze. Prvo prekida pi-vezu, koja je dio dvostrukog. Zatim molekula vode u obliku dviju čestica, hidroksid-aniona i kationa vodika dolazi u molekulu propilena, koja trenutno ima dva slobodna mjesta za stvaranje veza. Iksid hidroksida tvori vezu s manje hidrogeniranim atomom ugljika (tj. S jednim na koji je priključen manji broj vodikovih atoma) i proton s preostalim ekstremom. Dakle, dobivamo jedan proizvod: ograničenje monohidrični alkohol izopropanol.
Kako snimiti reakciju?
Sada saznajemo kako zapisati kemijsku reakciju koja odražava proces, kao što je hidratacija propilena. Formula koja će biti korisna: CH2 = CH-CH3. Ovo je formula početne tvari - propena. Kao što se može vidjeti, on ima dvostruku vezu s oznakom "=", a na ovom mjestu voda će biti pričvršćena kada se hidratiraju propilen. Reakcijska jednadžba može se napisati kao: CH2 = CH-CH3 + H2O = CH3 - CH (OH) -CH3. Hidroksilna skupina u zagradama znači da taj dio nije u ravnini formule, ali niži ili više. Ovdje ne možemo prikazati kutove između tri skupine koje odstupaju od prosječnog ugljikovog atoma, ali kažemo da su približno jednake jedna drugoj i iznose 120 stupnjeva.
Gdje se to primjenjuje?
Već smo rekli da se tvar dobivena tijekom reakcije aktivno koristi za sintezu drugih vitalnih tvari za nas. Vrlo je sličan strukturi acetona, što se razlikuje samo u tome, umjesto hidroksilne skupine, postoji keto skupina (to jest, atom kisika povezan dvostrukom vezom na dušikov atom). Kao što je poznato, sam aceton se koristi u lakovima i otapalima, ali osim toga, da se koristi kao reaktant za daljnju sintezu složenijih tvari kao što su poliuretani, epoksi smole, acetat anhidrida i tako dalje.

Reakcija za proizvodnju acetona
Smatramo da bi bilo suvišno opisati pretvorbu izopropil alkohola u aceton, pogotovo jer ova reakcija nije tako komplicirana. Za početak, propanol se upari i na 400-600 stupnjeva oksigenizira s posebnim katalizatorom. Vrlo čist proizvod dobiven je reakcijom na srebrnoj rešetki.

Reakcijska jednadžba
Nećemo ući u pojedinosti o mehanizmu reakcije oksidacije propanola u aceton jer je vrlo složen. Ograničavamo se na uobičajenu jednadžbu kemijske transformacije: CH3 - CH (OH) -CH3 + O2 = CH3 - C (0) -CH3 + H2O. Kao što možete vidjeti, sve je vrlo jednostavno na dijagramu, ali vrijedi kopati u proces i suočit ćemo se s nekim poteškoćama.
zaključak
Dakle, rastavili smo proces hidratacije propilena i proučavali jednadžbu reakcije i mehanizam njegova protoka. Razmatrani tehnološki principi temelje se na stvarnim procesima koji se javljaju u proizvodnji. Kao što se ispostavilo, oni nisu baš složeni, ali imaju stvarnu korist za naš svakodnevni život.
 Polipropilenski otpad: sakupljanje, prijem, prerada
Polipropilenski otpad: sakupljanje, prijem, prerada Dewar brod: od 19. stoljeća do danas
Dewar brod: od 19. stoljeća do danas Polimer - što je to? Proizvodnja polimera
Polimer - što je to? Proizvodnja polimera Polipropilenska ploča: vrste i tehničke karakteristike
Polipropilenska ploča: vrste i tehničke karakteristike Twine polipropilen: primjena, prednosti
Twine polipropilen: primjena, prednosti Formula polipropilena. Svojstva i primjena polipropilena
Formula polipropilena. Svojstva i primjena polipropilena Što kemijski djelatnik radi?
Što kemijski djelatnik radi? Polipropilenska pređa: svojstva i osnovna svojstva
Polipropilenska pređa: svojstva i osnovna svojstva Uran, kemijski element: povijest otkrića i reakcija nuklearne fisije
Uran, kemijski element: povijest otkrića i reakcija nuklearne fisije Tko je otkrio struju? Istraživanje i otkriće
Tko je otkrio struju? Istraživanje i otkriće Špulica polipropilena: glavna svojstva, primjena
Špulica polipropilena: glavna svojstva, primjena Plastične ploče: što rezati i kako
Plastične ploče: što rezati i kako Polipropilenska točka taljenja: svojstva i svojstva
Polipropilenska točka taljenja: svojstva i svojstva Polimerizacija propilena: shema, jednadžba, formula
Polimerizacija propilena: shema, jednadžba, formula Polipropilen - točka taljenja, svojstva i svojstva
Polipropilen - točka taljenja, svojstva i svojstva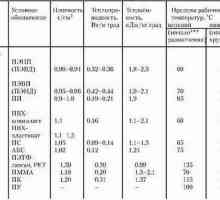 Talište polietilena i polipropilena
Talište polietilena i polipropilena Proizvodnja etilena
Proizvodnja etilena Kondenzat plina
Kondenzat plina Što je izopropil alkohol
Što je izopropil alkohol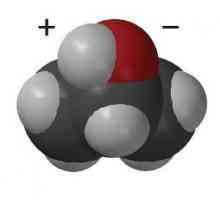 Propilni alkohol: svojstva i primjene
Propilni alkohol: svojstva i primjene Roll krovni materijali. Prednosti, nedostaci, glavni tipovi
Roll krovni materijali. Prednosti, nedostaci, glavni tipovi
 Dewar brod: od 19. stoljeća do danas
Dewar brod: od 19. stoljeća do danas Polimer - što je to? Proizvodnja polimera
Polimer - što je to? Proizvodnja polimera Polipropilenska ploča: vrste i tehničke karakteristike
Polipropilenska ploča: vrste i tehničke karakteristike Twine polipropilen: primjena, prednosti
Twine polipropilen: primjena, prednosti Formula polipropilena. Svojstva i primjena polipropilena
Formula polipropilena. Svojstva i primjena polipropilena Što kemijski djelatnik radi?
Što kemijski djelatnik radi? Polipropilenska pređa: svojstva i osnovna svojstva
Polipropilenska pređa: svojstva i osnovna svojstva Uran, kemijski element: povijest otkrića i reakcija nuklearne fisije
Uran, kemijski element: povijest otkrića i reakcija nuklearne fisije Tko je otkrio struju? Istraživanje i otkriće
Tko je otkrio struju? Istraživanje i otkriće Špulica polipropilena: glavna svojstva, primjena
Špulica polipropilena: glavna svojstva, primjena