Koji alkani su karakterizirani reakcijama
Svaka klasa kemijskih spojeva sposobna je pokazati svojstva zbog njihove elektroničke strukture. Alkanes su karakterizirane reakcijama supstitucije, cijepanja ili oksidacije molekula. Svi kemijski procesi imaju svoje perkolacijske karakteristike, o kojima će se raspravljati kasnije.
sadržaj
Što su alkani
To su zasićeni ugljikovodični spojevi, koji se nazivaju parafini. Njihove molekule sastoje se samo od atoma ugljika i vodika, imaju linearni ili razgranati aciklički lanac, u kojem postoje samo pojedinačni spojevi. S obzirom na karakteristike klase, moguće je izračunati koje su reakcije karakteristične za alkane. Pridržavaju se formule za cijeli razred: H2n + 2Cn.
Kemijska struktura
Molekula parafina uključuje ugljikove atome koji pokazuju sp3-hibridizacija. Sva četiri valentna orbita imaju isti oblik, energiju i smjer u prostoru. Kut između razina energije iznosi 109 ° i 28 `.
Prisutnost pojedinačnih veza u molekulama određuje koje su reakcije karakteristične za alkane. Oni su prisutni sigma - veze. Veza između ugljika je nepolarni i slabo polarizirane, što je nešto duži nego Cminus-H. Također se promatra promjena gustoće elektrona na ugljikov atom, kao i većina elektronskogegativnog. Kao rezultat toga, Cminus-H spoj je karakteriziran niskom polarnosti.
Reakcije supstitucije
Tvari klase parafina imaju slabu kemijsku aktivnost. To se može objasniti snagom veza između Cminus-C i Cminus-H, koje je teško razbiti zbog nepolarnosti. Njihovo razaranje temelji se na homolitičkom mehanizmu, u kojem sudjeluju radikali slobodnog tipa. Zbog toga se alkani karakteriziraju reakcijama supstitucije. Takve tvari nisu u mogućnosti komunicirati s molekulama vode ili ionima koji nose naboj.
Smatraju se slobodnom radikalnom supstitucijom, u kojoj su vodikovi atomi zamijenjeni halogeni elementima ili drugim aktivnim skupinama. Takve reakcije uključuju postupke povezane s halogeniranjem, sulfokloriranjem i nitracijom. Njihov rezultat je proizvodnja alkanskih derivata. U jezgri mehanizma supstitucijskih reakcija u slobodnom radikalu leže tri glavna faza:
U jezgri mehanizma supstitucijskih reakcija u slobodnom radikalu leže tri glavna faza:
- Postupak započinje inicijacijom ili nukleacijom lanca, zbog čega nastaju slobodni radikali. Katalizatori su ultraljubičasti izvori svjetlosti i grijanje.
- Zatim se razvija lanac u kojem se provode sukcesivne interakcije aktivnih čestica s neaktivnim molekulama. Njihova transformacija u molekule i radikale.
- Posljednji korak je prekid lanca. Promatra se rekombinacija ili nestanak aktivnih čestica. Time prestaje razvoj lančane reakcije.
Postupak halogeniranja
Temelji se na radikalnom tipu mehanizma. Reakcija halogeniranja alkana provodi se zračenjem ultraljubičastim i zagrijavanjem smjese halogena i ugljikovodika.
Sve faze procesa podliježu pravilu koje je Markovnikov izrazio. Navodi se da se podvrgava supstituciji halogenom, prije svega, atom vodika, koja pripada samom hidrogeniranom ugljiku. Halogeniranje se nastavlja u takvom slijedu: od tercijarnog atoma do primarnog ugljika.
Postupak je bolji za molekule alkana s dugim glavnim ugljikovim lancem. To je zbog smanjenja ionizirajuće energije u danom smjeru, elektron se lakše odvaja od tvari.
Primjer je kloriranje molekule metana. Djelovanje ultraljubičastog zračenja dovodi do podjele klora u radikalne čestice koje provode napad na alkan. Postoji odvojak atomskog vodika i stvaranje H3Cmiddot- ili metil radikal. Takva čestica, zauzvrat, napada molekularni klor, što dovodi do uništavanja njegove strukture i stvaranja novog kemijskog reagensa.
U svakoj fazi postupka, zamijenjen je samo jedan atom vodika. Reakcija halogeniranja alkana dovodi do postupno formiranja klormetana, diklormetana, triklorometana i tetraklormetanske molekule.
Shematski je postupak kako slijedi:
H4C + Cl: Cl-H3CCl + HC1,
H3CC1 + Cl: Cl-H2CCI2 + HCl,
H2CCI2 + Cl: Cl-HCCl3 + HCl,
HCCl3 + Cl: Cl-CCl4 + HCl.
Za razliku od kloracije molekula metana, provođenje takvog postupka s drugim alkanima je karakterizirano dobivanjem supstanci u kojima zamjena vodika ne dolazi u jednom ugljikovom atomu nego u nekoliko. Njihov kvantitativni odnos odnosi se na temperaturu. U hladnim uvjetima smanjuje se brzina formiranja derivata s tercijarnom, sekundarnom i primarnom strukturom.
Uz povećanje indeksa temperature, izjednačava se brzina stvaranja takvih spojeva. Na proces halogeniranja utječe statički faktor, što ukazuje na različitu vjerojatnost radikalnog sudara s atomom ugljika.

Proces halogeniranja s jodom se ne javlja u normalnim uvjetima. Potrebno je stvoriti posebne uvjete. Kada je izložen metanu s ovim halogenom, javlja se vodikov jodid. Na to utječe jodidni metil, zbog čega se oslobađaju izvorni reagensi: metan i jod. Takva se reakcija smatra reverzibilnom.
Wurzova reakcija za alkane
Je li metoda dobivanja zasićene ugljikovodike s simetričnom strukturom. Reaktivne tvari su natrijev metal, alkil bromidi ili alkil kloridi. Kada su u interakciji, dobiveni su natrij halogenid i povećani lanac ugljikovodika, što je zbroj dvaju ugljikovodičnih radikala. Shematski, sinteza je sljedeća: Rminus-Cl + Clminus-R + 2Na → Rminus-R + 2NaCl.
Wurzova reakcija za alkane je moguća samo ako su u njihovim molekulama halogeni smješteni na primarnom ugljikovom atomu. Na primjer, CH3minus-CH2minus-CH2Br.
Ako se u procesu sudjeluje halogen-ugljikovodična smjesa dvaju spojeva, nastaju tri različita produkta kada im se lanci kondenziraju. Primjer takve reakcije alkana je interakcija natrija s klormetanom i kloretanom. Izlaz je smjesa koja sadrži butan, propan i etan.
Uz natrij, možete koristiti i druge alkalijske metale, koji uključuju litij ili kalij.
Postupak sulfochlorination
Također se naziva Reedova reakcija. Ona teče prema principu zamjene slobodnih radikala. Ovo je tipično tip reakcije alkana djelovanjem mješavine sumpornog dioksida i molekularnog klora u prisutnosti ultraljubičastog zračenja.
Postupak započinje iniciranjem mehanizma lanca u kojem se dobivaju dva radikala iz klora. Jedan od njih napada alkan, što dovodi do pojave alkilne čestice i molekule klorovodika. Sumporov dioksid vezan je na ugljikovodični radikal da bi se formirala kompleksna čestica. Za stabilizaciju, jedan atom klora je zarobljen iz druge molekule. Konačna tvar je alkansulfonil klorid, koristi se u sintezi površinski aktivnih spojeva.
Shematski, proces ovako izgleda:
ClCl →hv Cl + Cl,
HR + · Cl → R + HCl,
R ∙ + OSO → ∙ RSO2,
∙ RSO2 + ClCl → RSO2Cl + Cl.
Procesi povezani s nitracijom
Alkani reagiraju s dušičnom kiselinom u obliku otopine od 10%, a također s dušikom tetravalentnog oksida u plinovitom stanju. Uvjeti za njegov prolaz su visoke temperature (oko 140 ° C) i niske vrijednosti tlaka. Na izlazu nastaju nitroalkani.
Ovaj proces slobodnog radikala nazvan je po znanstveniku Konovalovu, koji je otkrio sintezu nitriranja: CH4 + HNO3 → CH3NE2 + H2O.
Mehanizam cijepanja
Za alkane su karakteristične reakcije dehidrogenacije i krekiranja. Metansku molekulu prolazi potpunu termičku dekompoziciju.
Glavni mehanizam gore navedenih reakcija je uklanjanje atoma iz alkana.
Proces dehidrogenacije
Kada se odvajaju vodikovi atomi iz ugljikovog kostura parafina, osim metana, dobivaju se nezasićeni spojevi. Takve kemijske reakcije alkana odvijaju se pod uvjetima visoke temperature (od 400 do 600 ° C) i pod djelovanjem akceleratora u obliku platine, nikla, kroma oksida i aluminij.
Ako reakcija uključuje molekule propana ili etana, tada će njegovi proizvodi biti propen ili eten s jednom dvostrukom vezom.
Kada se dehidrogenizira kostur od četiri ili pet ugljikovih atoma, dobiveni su dieni spojevi. Butan se dobiva iz butan-1,3 i butadien-1,2.
Ako reakcija sadrži tvari s 6 ili više ugljika, nastaje benzen. Ima aromatsku jezgru s tri dvostruke veze.
Proces povezan s raspadom
Pod visokim temperaturama, reakcije alkana mogu nastaviti s lomljenjem ugljikovih veza i formiranjem aktivnih čestica radikala. Takvi se procesi nazivaju pucanje ili piroliza.
Zagrijavanje reaktanata na temperaturu iznad 500 ° C dovodi do raspada njihovih molekula, tijekom kojih nastaju složene smjese alkilnih radikala.
Izvođenje jakog zagrijavanja pirolize alkana s dugim ugljikovim lancima povezano je s dobivanjem ograničavajućih i nezasićenih spojeva. Naziva se toplinsko pucanje. Taj se postupak koristio do sredine 20. stoljeća.
Nedostatak je bila proizvodnja ugljikovodika s niskim oktanskim brojem (ne više od 65), pa je zamijenjena katalitičko krekiranje. Proces se odvija pri temperaturama koje su ispod 440 ° C, i tlaku od manje od 15 bara, u prisustvu alumosilikatne alkana akceleratora oslobađanjem koji ima razgranatu strukturu. Primjer je piroliza metana: 2CH4 →t°C2H2+ 3H2. Tijekom ove reakcije nastaju acetilen i molekularni vodik.
Metan molekula može proći pretvorbu. Za takvu reakciju potrebno je vodu i nikalni katalizator. Izlaz je mješavina ugljičnog monoksida i vodika.
Oksidacijski procesi
Kemijske reakcije karakteristične za alkane odnose se na oslobađanje elektrona.
Postoji auto-oksidacija parafina. To uključuje slobodni radikalni mehanizam oksidacije zasićenih ugljikovodika. Tijekom reakcije, hidroperoksidi se dobivaju iz tekuće faze alkana. U početnoj fazi, parafinska molekula reagira s kisikom, što rezultira otpuštanjem aktivnih radikala. Dalje s alkilnom česticom, druga molekula O2, Ispada da ∙ ROO. S radikalom peroksi masne kiseline dodana je alkanska molekula, nakon čega se oslobađa hidroperoksid. Primjer je auto-oksidacija etana:
C2H6 + O2 → ∙ C2H5 + HOO ∙,
∙ C2H5 + O2 → ∙ OOC2H5,
∙ OOC2H5 + C2H6 → HOOC2H5 + ∙ C2H5.
Alkani su karakterizirani reakcijama izgaranja, koje pripadaju glavnim kemijskim svojstvima, kada su određene u sastavu goriva. Oni imaju oksidativni karakter s otpuštanjem topline: 2C2H6 + 7D2 → 4CO2 + 6H2O.
Ako se u procesu promatra mala količina kisika, konačni proizvod može biti ugljen ili ugljik dvovalentni oksid, koji se određuje koncentracijom O2.
U oksidaciji alkana pod utjecajem katalitičkih tvari i zagrijavanjem do 200 ° C, dobivene su molekule alkohola, aldehida ili karboksilne kiseline.
Primjer etana:
C2H6 + O2 → C2H5OH (etanol),
C2H6 + O2 → CH3CHO + H2O (etanol i voda),
2C2H6 + 3O2 → 2CH3COOH + 2H2O (etanolna kiselina i voda).
Alkanes se mogu oksidirati djelovanjem tročlanih cikličkih peroksida na njih. One uključuju dimetildioxirane. Rezultat oksidacije parafina je alkoholna molekula.
Predstavnici parafina ne reagiraju na KMnO4 ili kalijevog permanganata, kao i bromovom vodom.
izomerizacije
Za alkane tip reakcije karakterizira supstitucija elektrofilnim mehanizmom. Ovo je izomerizacija lanca ugljika. Katalitira ovaj proces aluminij klorida, koji djeluje u interakciji sa zasićenim parafinom. Primjer je izomerizacija molekule butana, koja postaje 2-metilpropan: C4H10 → C3H7CH3.
Postupak aromatizacije
Zasićene tvari, u kojima glavni ugljikov lanac sadrži šest ili više ugljikovih atoma, sposobni su dehidrociklizirati. Za kratke molekule, ova reakcija nije tipična. Rezultat je uvijek šesteročlani ciklus u obliku cikloheksana i njegovih derivata.
U prisutnosti reakcijskih ubrzivača, odvija se daljnja dehidrogenacija i konverzija u stabilniji benzenski prsten. Aciklički ugljikovodici se pretvaraju u aromatske spojeve ili arene. Primjer je dehidrociklizacija heksana:
H3Cminus CH2minus- CH2minus- CH2minus- CH2minus-CH3 → C6H12 (Cikloheksan)
C6H12 → C6H6 + 3H2 (Benzen).
 Organski materijal njihovih svojstava i klasifikacije
Organski materijal njihovih svojstava i klasifikacije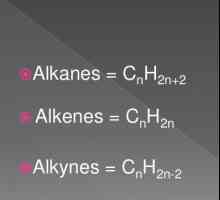 Opća formula alkena. Svojstva i svojstva alkena
Opća formula alkena. Svojstva i svojstva alkena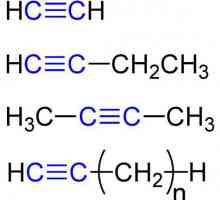 Kemijska svojstva alkina. Struktura, prijem, primjena
Kemijska svojstva alkina. Struktura, prijem, primjena Kako napraviti izomere i homologe? Kako napraviti izomere alkana?
Kako napraviti izomere i homologe? Kako napraviti izomere alkana? Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane
Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane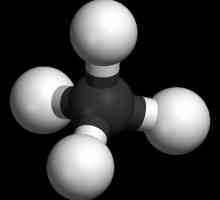 Alkadieni su tipični predstavnici nezasićenih ugljikovodika
Alkadieni su tipični predstavnici nezasićenih ugljikovodika Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari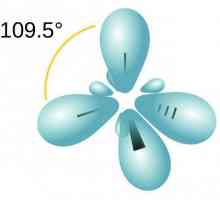 Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije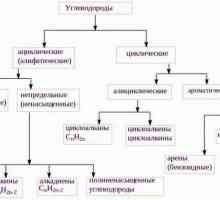 Što su alifatski ugljikovodici?
Što su alifatski ugljikovodici?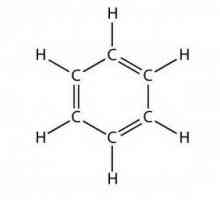 Što je benzen? Struktura benzena, formula, svojstva, primjena
Što je benzen? Struktura benzena, formula, svojstva, primjena Zasićeni ugljikovodici: svojstva, formule, primjeri
Zasićeni ugljikovodici: svojstva, formule, primjeri Organski spojevi i njihova klasifikacija
Organski spojevi i njihova klasifikacija Kemijska svojstva alkana
Kemijska svojstva alkana Reakcije smanjenja oksidacije
Reakcije smanjenja oksidacije Klase anorganskih spojeva
Klase anorganskih spojeva Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva
Ograničiti ugljikovodike: opće karakteristike, izomerizam, kemijska svojstva Serije homologije
Serije homologije Upotreba alkana
Upotreba alkana Alkanes: kemijska svojstva
Alkanes: kemijska svojstva Izomeri heptana: opća karakteristika i primjena
Izomeri heptana: opća karakteristika i primjena Propan je ekološko gorivo. Njegova fizička i kemijska svojstva
Propan je ekološko gorivo. Njegova fizička i kemijska svojstva
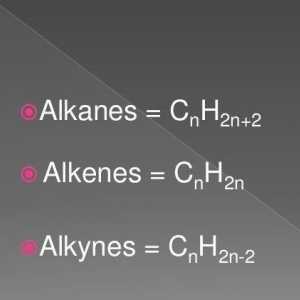 Opća formula alkena. Svojstva i svojstva alkena
Opća formula alkena. Svojstva i svojstva alkena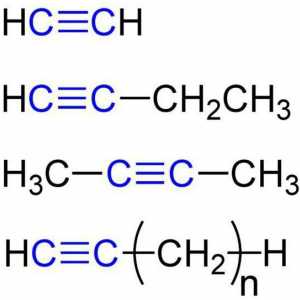 Kemijska svojstva alkina. Struktura, prijem, primjena
Kemijska svojstva alkina. Struktura, prijem, primjena Kako napraviti izomere i homologe? Kako napraviti izomere alkana?
Kako napraviti izomere i homologe? Kako napraviti izomere alkana? Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane
Ciklički zasićeni ugljikovodici: kako su proizvedeni. cikloalkane Alkadieni su tipični predstavnici nezasićenih ugljikovodika
Alkadieni su tipični predstavnici nezasićenih ugljikovodika Kako odrediti kvalitativni i kvantitativni sastav tvari
Kako odrediti kvalitativni i kvantitativni sastav tvari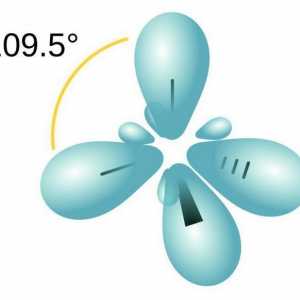 Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije Što su alifatski ugljikovodici?
Što su alifatski ugljikovodici? Što je benzen? Struktura benzena, formula, svojstva, primjena
Što je benzen? Struktura benzena, formula, svojstva, primjena Zasićeni ugljikovodici: svojstva, formule, primjeri
Zasićeni ugljikovodici: svojstva, formule, primjeri