Što je kemijska tvar? Svojstva tvari. Kategorije tvari
Glavno pitanje da neka osoba mora znati odgovor kako bi ispravno razumjela sliku svijeta je ono što je materija u kemiji. Ovaj koncept nastaje čak i u dobi škole i usmjerava dijete u daljnji razvoj. Stupanje na proučavanje kemije, važno je pronaći zajedničko tlo s njim na svakodnevnoj razini, što nam omogućuje jasno i lako objašnjenje određenih procesa, definicija, svojstava itd.
sadržaj
Nažalost, zbog nesavršenosti obrazovnog sustava, mnogi nedostaju neki temeljni elementi. Koncept "tvari u kemiji" neka je kamen temeljac, pravovremena asimilacija ove definicije daje osobi pravo početak u daljnjem razvoju u području prirodnih znanosti.
Formiranje koncepta
Prije prelaska na koncept materije, potrebno je utvrditi koji je predmet kemije. Tvari su ono što sama kemija proučava, njihove međusobne transformacije, strukture i svojstva. Općenito, tvar je ono što se sastoje od fizičkih tijela.
I tako, da takva supstanca u kemiji? Formirajte definiciju pomicanjem iz općeg koncepta na čisto kemijski element. Tvar je određena vrsta materije koja nužno ima masu koja se može izmjeriti. Ova karakteristika razlikuje tvar od druge vrste materije - polja koja nema masu (električno, magnetsko, biološko polje, itd.). Materijal, zauzvrat, je ono što smo stvoreni i što nas okružuje.
Nešto drugačija karakteristika materije, koja određuje što se točno sastoji, već je predmet kemije. Tvari se formiraju atomima i molekulama (neki ioni), što znači da je svaka supstanca koja se sastoji od ovih formulnih jedinica materija.
Jednostavne i složene tvari
Nakon svladavanja osnovne definicije, možete nastaviti do njegove komplikacije. Tvari dolaze u različitim razinama organizacije, tj. Jednostavne i složene (ili spojeve) - to je prva podjela na klase supstanci, kemija ima mnogo kasnijih podjela, detaljan i složeniji. Ova klasifikacija, za razliku od mnogih drugih, ima strogo definirane granice, svaka veza može se jasno pripisati jednoj od tipova koji međusobno isključuju.
Jednostavna tvar u kemiji je spoj koji se sastoji od atoma samo jednog elementa iz periodičnog stola Mendelejev. U pravilu, to su binarne molekule, to jest, koje se sastoje od dvije čestice koje su povezane pomoću kovalentne nepolarne veze - stvaranje ukupnog nesparenog elektronskog para. Tako atomi istog kemijskog elementa imaju identičnu elektronegativnost, tj. Sposobnost zadržavanja ukupne gustoće elektrona, pa nije pristran ni na jedan od sudionika veze. Primjeri jednostavnih tvari (nonmetali) su vodik i kisik, klor, jod, fluor, dušik, sumpor itd. Od tri atoma je molekula takve tvari kao što je ozon, a iz jednog - sve plemenite plinove (argon, ksenon, helij, itd.). U metalima (magnezij, kalcij, bakar, itd.) Postoji vlastiti tip veze - metal, koji je rezultat socijalizacije slobodnih elektrona unutar metala i ne nastaje formiranje molekula kao takvog. Kod snimanja metalne tvari, simbol kemijskog elementa označen je bez ikakvih indeksa.
Jednostavna tvar u kemiji, primjeri koji su dani gore, razlikuju se od kompleksa kvalitativnim sastavom. Kemijski spojevi formirani su pomoću atoma različitih elemenata, od dva ili više. U takvim tvarima postoji kovalentni polarni ili ionski tip vezanja. Budući da različiti atomi imaju drukčiju elektronegativnost, onda kada nastaje zajednički elektronski par, ona se prebacuje na više elektronskih elemenata, što dovodi do opće polarizacije molekule. Tip iona je ekstremni slučaj polarnog, kada se par elektrona potpuno prolazi do jednog od sudionika vezivanja, tada se atomi (ili njihove skupine) pretvaraju u ione. Ne postoji jasna granica između ovih tipova, ionska se veza može tumačiti kao kovalentno snažno polarno. Primjeri složenih tvari - voda, pijesak, staklo, soli, oksidi itd.
Izmjena tvari
Tvari zovu jednostavnim, u stvari imaju jedinstvenu značajku koja nije inherentna složenom. Neki kemijski elementi mogu oblikovati nekoliko oblika jednostavne tvari. U srcu svega je samo jedan element, ali kvantitativni sastav, struktura i svojstva radikalno razlikuju takve formacije. Ova se značajka naziva alotropijom.
Kisik, sumpor, ugljik i drugi elementi imaju nekoliko alotropne modifikacije. Za kisik, to je O2 i O3, ugljik daje četiri vrste tvari - carbyne, diamond, grafit i fullerene, molekula sumpora je romboidna, monoklinska i plastična modifikacija. Takva jednostavna tvar u kemiji, čiji primjeri nisu ograničeni na gore navedeno, od velike je važnosti. Posebno, fullereni se koriste kao poluvodiči u tehnologiji, fotoresistori, aditivi za rast dijamantnih filmova i za druge namjene, au medicini su to najsnažniji antioksidanti.
Što se događa s tvarima?
Svaka sekunda iznutra i oko njega dolazi do transformacije tvari. Kemija razmatra i objašnjava one procese koji dolaze s kvalitativnom i / ili kvantitativnom promjenom u sastavu molekula koje reagiraju. Paralelno, fizičke transformacije često javljaju međusobno povezane, koje karakteriziraju samo promjene u obliku, boji materije ili agregatnom stanju i nekim drugim karakteristikama.
Kemijski fenomeni su reakcije interakcije različitih vrsta, na primjer, spojeva, supstitucija, razmjena, razgradnja, reverzibilna, egzotermna, redoks itd. Ovisno o promjeni parametra od interesa. K fizičke pojave uključuju: isparavanje, kondenzacija, sublimacija, otapanje, zamrzavanje, električna vodljivost itd. Često se prate jedni druge, na primjer, munje tijekom grmljavine je fizički proces, a puštanje pod djelovanje ozona kemijski je proces.
Fizička svojstva
Tvar u kemiji je stvar koja ima određena fizička svojstva. Zbog njihove prisutnosti, odsutnosti, stupnja i intenziteta, može se predvidjeti kako se supstanca ponaša pod određenim uvjetima, a također objašnjavaju neke od kemijskih svojstava spojeva. Na primjer, temperatura visokog vrelišta organski spojevi, u kojima je vodik, a elektro heteroatom (dušik, kisik, itd), pokazuju da je tvar pokazuje kemijske interakcije tipa, kao što su vodikove veze. Zahvaljujući znanju koje tvari imaju najbolju moguću sposobnost provođenja električne struje, kabeli i žice ožičenja izrađeni su od određenih metala.
Kemijska svojstva
Osnivanje, istraživanje i proučavanje druge strane medalja svojstava odnosi se na kemiju. Svojstva tvari s njezine točke gledišta njihova je reaktivna sposobnost interakcije. Neke tvari su izuzetno aktivne u ovom smislu, na primjer, metali ili bilo koji oksidansi, i drugi, plemenit (inertan) plinovi, u normalnim uvjetima praktički ne ulaze u reakciju. Kemijska svojstva mogu se aktivirati ili pasivirati ako je potrebno, ponekad ne uključuje posebne poteškoće, au nekim slučajevima to nije lako. Znanstvenici provode mnogo sati u laboratorijima, pokusom i pogreškom pokušavajući postići svoje ciljeve, ponekad ih ne dođu do njih. Promjena parametara okoliša (temperatura, tlak itd.) Ili korištenjem posebnih spojeva - katalizatora ili inhibitora - može utjecati na kemijska svojstva tvari, a time i tijek reakcije.
Razvrstavanje kemikalija
Sve klasifikacije temelje se na odvajanju spojeva u organskim i anorganskim spojevima. Glavni Organski elementa - ugljik, povezuje jedan s drugim i hydrogenic atoma ugljika formirali ugljikovodikov kostur koji nakon ispunjen drugim atomima (kisik, dušik, fosfor, sumpor, halogena, metala, i drugi), zatvara u ciklusima ili razgranati, čime se dokazuje širok raspon organskih spojeva. Do danas znanost zna 20 milijuna tih tvari. Dok su mineralni spojevi samo pola milijuna.
Svaki spoj je individualan, ali ima mnogo sličnosti s drugima u svojstvima, strukturi i sastavu, na temelju toga, grupira se u klase tvari. Kemija ima visoku razinu sistematizacije i organizacije, to je točno znanost.
Anorganske tvari
1. Oksidi - binarni spojevi s kisikom:
a) Kiselina - u interakciji s vodom daje kiselinu;
b) osnovno - kada se interakciju s vodom daje temelj.
2. Kiseline - tvari koje se sastoje od jednog ili više vodikovih protona i kiselih ostataka.
3. Baze (alkalne) - sastoje se od jedne ili više hidroksilnih skupina i jednog atoma metala:
a) amfoterni hidroksidi - pokazuju svojstva i kiselina i baza.
4. Soli su rezultat neutralizacijske reakcije između kisele i alkalne (topljive baze), sastoje se od atoma metala i jednog ili više kiselinskih ostataka:
a) kisele soli - anion kiselinskog ostatka ima proton u sastavu, rezultat nepotpune disocijacije kiseline;
b) bazične soli - hidroksilna skupina je vezana na metal, rezultat nepotpune disocijacije baze.
Organski spojevi
Klase tvari u organici su velike, ova je količina informacija teško odmah zapamtiti. Glavno je znati osnovne odjeljke za alifatske i cikličke spojeve, karbocikličke i heterocikličke, ograničavajući i nezasićene. Također ugljikovodici imaju mnoge derivate u kojima je atom vodika zamijenjen sa halogenom, kisikom, dušikom i drugim atomima, kao i sa funkcionalnim skupinama.
Tvar u kemiji temelj je postojanja. Zahvaljujući organskoj sintezi, čovjek danas ima ogroman broj umjetnih tvari koje zamjenjuju prirodno, a također nemaju analogije u svojstvima u prirodi.
 Što je kemofilija i kemofobija? Što uzrokuje strah za znanost kod ljudi?
Što je kemofilija i kemofobija? Što uzrokuje strah za znanost kod ljudi? Podrijetlo riječi "kemija": hipoteza izgleda, a ne samo
Podrijetlo riječi "kemija": hipoteza izgleda, a ne samo Misao u filozofiji
Misao u filozofiji Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari
Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari Što kemijski djelatnik radi?
Što kemijski djelatnik radi? Zakon stalnosti sastava materije. Zakoni očuvanja u kemiji
Zakon stalnosti sastava materije. Zakoni očuvanja u kemiji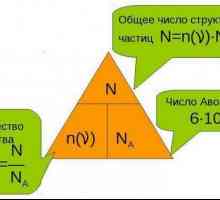 Koja je količina materije i kako se određuje?
Koja je količina materije i kako se određuje? Što je OVR u suvremenoj kemiji?
Što je OVR u suvremenoj kemiji? Što je moljac u kemiji? Definicija i formule
Što je moljac u kemiji? Definicija i formule Koji je pokazatelj u kemiji: definicija, primjeri, načelo djelovanja
Koji je pokazatelj u kemiji: definicija, primjeri, načelo djelovanja Organska i fizkolloidnaya kemija: opis, zadaci i značajke
Organska i fizkolloidnaya kemija: opis, zadaci i značajke Što je materija: klase, karakteristike, svojstva. Fizička svojstva tvari
Što je materija: klase, karakteristike, svojstva. Fizička svojstva tvari Vrste tvari: tvari, fizičko polje, fizički vakuum. Koncept materije
Vrste tvari: tvari, fizičko polje, fizički vakuum. Koncept materije Osnovni zakoni kemije
Osnovni zakoni kemije Fizičke tvari: primjeri i opis
Fizičke tvari: primjeri i opis Struktura materije
Struktura materije Mjera je objektivna ili subjektivna stvarnost?
Mjera je objektivna ili subjektivna stvarnost? Prvi zakon termodinamike
Prvi zakon termodinamike Kemija je uzbudljiva!
Kemija je uzbudljiva! Glavni dijelovi kemije: opis, značajke i zanimljive činjenice
Glavni dijelovi kemije: opis, značajke i zanimljive činjenice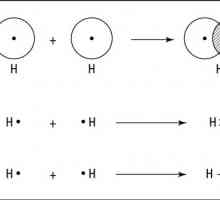 Predmet i zadaci kemije. Opća kemija. Organska kemija
Predmet i zadaci kemije. Opća kemija. Organska kemija
 Podrijetlo riječi "kemija": hipoteza izgleda, a ne samo
Podrijetlo riječi "kemija": hipoteza izgleda, a ne samo Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari
Što je materija? Koje su klase tvari. Razlika između organskih i anorganskih tvari Što kemijski djelatnik radi?
Što kemijski djelatnik radi? Zakon stalnosti sastava materije. Zakoni očuvanja u kemiji
Zakon stalnosti sastava materije. Zakoni očuvanja u kemiji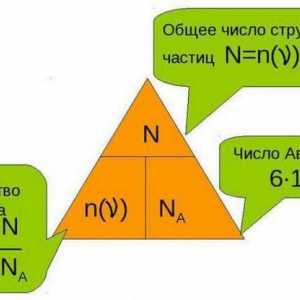 Koja je količina materije i kako se određuje?
Koja je količina materije i kako se određuje? Što je OVR u suvremenoj kemiji?
Što je OVR u suvremenoj kemiji? Što je moljac u kemiji? Definicija i formule
Što je moljac u kemiji? Definicija i formule Koji je pokazatelj u kemiji: definicija, primjeri, načelo djelovanja
Koji je pokazatelj u kemiji: definicija, primjeri, načelo djelovanja Organska i fizkolloidnaya kemija: opis, zadaci i značajke
Organska i fizkolloidnaya kemija: opis, zadaci i značajke