Koncentracija otopina
Koncentracija rješenja - pojam koji je prilično uobičajen i u znanstvenim krugovima i u domaćinstvu vokabulara - karakterizira kvantitativnu strukturu sastava bilo kojeg rješenja. U skladu s normama i definicijama IUPAC-a (međunarodni registar kemijskih spojeva), koncentracija se smatra omjerom mase tvari i otopine. Mjerenje ovog omjera je napravljeno u jedinicama mol / l, ili g / l.
sadržaj
Ako uzmemo u obzir tvari, koji dio se može izraziti na isti tip vrijednosti (na primjer, težina prema težini), oni odražavaju omjer prihvatio režnjeva, ali u praksi raširenije korištenje je koncept dobila koncentracija rješenja.
Postoji nekoliko opcija s kojima možete odražavati koncentraciju. Za otopine najčešće koristi izraz u strukturi otopini od mase i volumena (za tekućine) Postotak može izraziti koncentraciju u mol, nadalje, koncentracija otopine se može izraziti u gram ekvivalenata. U nekim slučajevima, koncentracija korištenje opcije refleksije preko titra ili metrički molarnosti.
U pravilu, koncentracija otopina, koja ne zahtjeva veliku točnost u njihovom izražavanju, prikazana je masenim postotkom. Na istom mjestu, gdje je potrebna visoka točnost, koriste se moljaci, naslovi ili gramski ekvivalenti.
Kada se koristi maseni postotak, primjenjuje se pravilo prema kojemu je izraz koncentracije označen u istim jedinicama, na primjer, koliko je grama tvari sadržano u takvoj količini grama otopine. Ne možete kombinirati odraz u gramima i volumnim jedinicama (na primjer: broj gramova tvari u 100 ml otopine).
Na primjer, ako trebamo izraziti sastav 10% -tne otopine sol sol, formula gdje je NaCl, tada se podrazumijeva da da 100 g otopine sadrži 10 grama soli i 90 g vode. U tom slučaju, ako je koncentracija je dano u jedinicama posto težine tvari (na primjer, 25% otopine), te potreba da se količine otopine koja je bila točno navedene količine tvari (npr 5 g), otopina treba uzeti za masu (u ovom primjeru, 20 g).
Za svaku varijantu refleksije koncentracije, postoji formula. Dakle, ako se koristi postotak koncentracije otopine, formula ima sljedeći oblik:
C = m1 / m, u kojoj: m1 je masa tvari otopljene u danoj otopini i izražena u gramima ili kilogramima, m je masa otopine izražene u istim jedinicama.
Molarna koncentracija tvari u otopini određena je formulom: C (M) = n / V, gdje je n količina tvari u molovima, V je volumen otopine u litrama. Kada se koristi gram ekvivalent, formula ima oblik: C (N) = z / V, gdje je V volumen otopine izražen u litrama, a z je broj ekvivalencije.
U onim slučajevima gdje je poznata gustoća otopine, prikladnije je odražavati volumen. Ali to je samo kada je riječ o dovoljno koncentriranim rješenjima (manje od 1%), jer pogreška u ovom slučaju može biti beznačajna.
Izraženo u broju molova, koncentracija u kemiji naziva se molarnost. Ako kažu: "unmolar solution", onda to znači da 1 litra tekućine sadrži 1 mola tvari. Takvo rješenje se također naziva jednostavno "molarna".
Ako se koncentracija izražava brojem gramskih ekvivalenata koji se nalaze u jedinici volumena tekućine, tada se koristi izraz "normalnost", što pokazuje da, na primjer, 1 gram tekućine sadrži ekvivalent od 1 grama. Najčešće se takvo rješenje jednostavno naziva normalnim.
U članku se razmatraju samo neke osnovne metode izražavanja koncentracija. U drugim slučajevima, kada je riječ o složenim rješenjima, za to se mogu koristiti druge jedinice.
 Lijek "Regidron". Primjena za normalizaciju ravnoteže vode i elektrolita u tijelu
Lijek "Regidron". Primjena za normalizaciju ravnoteže vode i elektrolita u tijelu Hipertenzivna otopina: svojstva, primjena, priprema
Hipertenzivna otopina: svojstva, primjena, priprema Nezamjenjiva fiziološka otopina: sastav, uporaba u medicinskim ustanovama i kod kuće
Nezamjenjiva fiziološka otopina: sastav, uporaba u medicinskim ustanovama i kod kuće Osmotski tlak
Osmotski tlak Što je disocijacija vode?
Što je disocijacija vode? Stupanj disocijacije slabih i jakih elektrolita
Stupanj disocijacije slabih i jakih elektrolita Koncentracija mole. Koja je molarna i molalna koncentracija?
Koncentracija mole. Koja je molarna i molalna koncentracija? Kako napraviti 10 posto otopina slane otopine? Nevjerojatna ljekovita svojstva soli. Obrada soli
Kako napraviti 10 posto otopina slane otopine? Nevjerojatna ljekovita svojstva soli. Obrada soli Koncentracija i gustoća sumporne kiseline. Ovisnost gustoće sumporne kiseline na koncentraciji u…
Koncentracija i gustoća sumporne kiseline. Ovisnost gustoće sumporne kiseline na koncentraciji u… Disocijacija složenih spojeva
Disocijacija složenih spojeva Izotonički koeficijent
Izotonički koeficijent Kakva je normalnost rješenja? Kako odrediti normalnost rješenja? Formula za normalnost otopine
Kakva je normalnost rješenja? Kako odrediti normalnost rješenja? Formula za normalnost otopine Problemi s rješenjima i metodama za njihovo rješavanje
Problemi s rješenjima i metodama za njihovo rješavanje Rješenja: koncentracija, masena frakcija. Definicija, izračun i preporuke
Rješenja: koncentracija, masena frakcija. Definicija, izračun i preporuke Otopina natrijevog klorida. opis
Otopina natrijevog klorida. opis Sustavi raspršivanja: opće karakteristike i klasifikacija
Sustavi raspršivanja: opće karakteristike i klasifikacija Pufer otopine: priprema i uporaba
Pufer otopine: priprema i uporaba Čimbenici koji utječu na brzinu kemijske reakcije
Čimbenici koji utječu na brzinu kemijske reakcije Pravo rješenje: definicija, svojstva, sastav, svojstva, primjeri
Pravo rješenje: definicija, svojstva, sastav, svojstva, primjeri Koncentracija proizvodnje
Koncentracija proizvodnje Raoulov zakon.
Raoulov zakon.
 Nezamjenjiva fiziološka otopina: sastav, uporaba u medicinskim ustanovama i kod kuće
Nezamjenjiva fiziološka otopina: sastav, uporaba u medicinskim ustanovama i kod kuće Koncentracija mole. Koja je molarna i molalna koncentracija?
Koncentracija mole. Koja je molarna i molalna koncentracija? Kako napraviti 10 posto otopina slane otopine? Nevjerojatna ljekovita svojstva soli. Obrada soli
Kako napraviti 10 posto otopina slane otopine? Nevjerojatna ljekovita svojstva soli. Obrada soli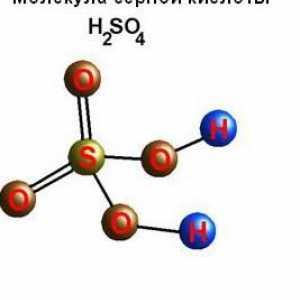 Koncentracija i gustoća sumporne kiseline. Ovisnost gustoće sumporne kiseline na koncentraciji u…
Koncentracija i gustoća sumporne kiseline. Ovisnost gustoće sumporne kiseline na koncentraciji u…