Amonijeve soli - metode proizvodnje, uporabe u nacionalnom gospodarstvu
U kemijskim spojevima NH4 + se očituje kao pozitivan, pojedinačno napunjen kation alkalijskog metala. Kod interakcije s kiselim anionima, tvari s kristalnom strukturom - soli amonij: nitrat
sadržaj
Amonijeve soli dobivaju se u tijeku reakcija neutralizacije, koji se provodi u procesu interakcije amonijaka s kiselinama.
amonijeve soli, kao što je, u načelu, u većini slučajeva alkalnog metala mogu disocirati (podijeliti na kationa i aniona) u vodenoj otopini na ione: amonijeve soli, soli alkalijskih metala kao što disociraju na ione:
NH4N03 harr-NH4 ++ NO3;
Tijekom procesa zagrijavanja, suhe amonijeve soli se raspadaju u amonijak i kiselinu - taj proces se također naziva termička disocijacija.
Oblikovana kiselina (na primjer klorovodična kiselina), zajedno s NH3 ispari i nakon hlađenja se veže s amonijakom i dobiven je sol. Treba reći da je i proces reverzibilnog razgradnje moguć:
NH3 + HCl harr- NH4Cl
Tako, amonijev klorid sublimira pri zagrije, ali nakon nekog vremena na vrhu cijevi ponovno pojavi bijeli premaz amonij klorida. Kao posljedica toga, formiranje soli nehlapljivih kiseline, npr, (NH4) 2S04, isparava tijekom zagrijavanja samo NH3, a ostaje kiseline. Takav se proces naziva nepovratnim razgradnjom.
Sve amonijeve soli dobro se razgrađuju lužinama (uz zagrijavanje) s evolucijom amonijaka:
NH4 + + OH-harr-NH3uRr + H20
Ova se reakcija koristi za prepoznavanje mineralnih gnojiva s amonijevim oblikom dušika.
U interakciji amonijevog karbonata s mineralima i organskih kiselina ugljični dioksid je oslobođen. U interakciji amonijevog sulfata ili klorida s AgN03 ili BaCl, karakteristični precipitiraju, bijeli, oblik.
Amonijeve soli: primjeri
Amonij soli se široko koriste u poljoprivredi. To je izvrstan materijal za mineralnu gnojidbu biljaka (na primjer, amonijev sulfat - (NH4) 2S04). Kao što je poznato, biljke mogu samo metabolizirati dušik u vezanom obliku (NO3, NH4). Zbog toga su dušični spojevi vrlo učinkoviti. Od velike važnosti je amonijev nitrat, koji sadrži amonij NH4 nitrat NO3-dušik.
I amonijev dihidrogen fosfat, poznat pod imenima MAP NH4H2P04 i diamonijeve fosfat (NH4) 2NR04 sadrže dva kemijska elementa - ishranu biljaka dušik i fosfor. Amonijeve soli su dio smjese gnojiva.
U reakciji amonijaka s ugljikovim monoksidom (IV) sintetizirana je urea ili karbamid NH2-CO-NH2.
U galvanskim ćelijama se koristi amonijev klorid (NH4C1) ili amonijak, za bojenje i tiskanje, tlačenje i lemljenje. U dodiru s grijanim metalima, amonijak se raspada u klorovodik i amonijak. Klorovodična kiselina međudjeluje s oksidom koji zagađuje površinu metala, uz stvaranje hlapive soli.
Treba napomenuti da se lemljenje dobro prianja na čistu površinu. NH4N03 (amonijev nitrat) zajedno s ugljenim i aluminijskim solima sastavni su dio eksplozivno-amonijskog. Ovi spojevi se koriste u razvoju stijena. Amonij bikarbonat (NH4HCO3) često se koriste u hrani i konditorskoj industriji. Ovaj spoj se također koristi kao konzervans za različite vrste hrane. NH4HCO3 ima svojstva denitrofitsiruyuschimi, što pomaže da se ubrza sazrijevanje usjeva.
Kvalitativna reakcija na amonijeve soli. Kada se otopina amonijevih soli s alkalijem grije, amonijev hidroksid, koji je podijeljen evolucijom amonijaka.
Prisutnost amonijaka može se procijeniti specifičnim mirisom, kao i upotrebom indikatora u boji. Da bi se izvršila ova reakcija, potrebno je uzeti 1,0 cm3 otopine amonijeve soli da se doda 0,5 cm3 otopine natrij hidroksid i topline. U procesu grijanja, oslobađa se amonijak, formira se karakterističan miris, crveni lakmus postaje plavo.
 Stupanj disocijacije slabih i jakih elektrolita
Stupanj disocijacije slabih i jakih elektrolita Voda od amonijaka: priprema, formula, primjena
Voda od amonijaka: priprema, formula, primjena Formula amonijaka. Amonijev hidroksid je vodena otopina amonijaka
Formula amonijaka. Amonijev hidroksid je vodena otopina amonijaka Soli. Amonij bikarbonat
Soli. Amonij bikarbonat Bertoletova sol
Bertoletova sol Dvostruke soli: primjeri i nazivi
Dvostruke soli: primjeri i nazivi Soli ugljika amonijaka: opis, sastav, opseg primjene
Soli ugljika amonijaka: opis, sastav, opseg primjene Hidroliza: molekularna i ionska jednadžba. Jednadžba reakcije hidrolize
Hidroliza: molekularna i ionska jednadžba. Jednadžba reakcije hidrolize Kiseline
Kiseline Anhidrid octene kiseline: svojstva, proizvodnja i primjena
Anhidrid octene kiseline: svojstva, proizvodnja i primjena Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje
Amfoterni oksidi. Kemijska svojstva, metoda proizvodnje Magnezijev hidroksid. Fizička i kemijska svojstva. Primjena.
Magnezijev hidroksid. Fizička i kemijska svojstva. Primjena. Propanoična kiselina. Fizička i kemijska svojstva. Primjena, zaštita na radu.
Propanoična kiselina. Fizička i kemijska svojstva. Primjena, zaštita na radu. Adipinska kiselina. Svojstva i aplikacije
Adipinska kiselina. Svojstva i aplikacije Osnovni oksidi i njihova svojstva
Osnovni oksidi i njihova svojstva Kemijska svojstva kiselina
Kemijska svojstva kiselina Amonijev hidroksid i njegova uporaba
Amonijev hidroksid i njegova uporaba Osnovne soli. Kategorija `borati`
Osnovne soli. Kategorija `borati` Kemijska svojstva soli i postupci za njihovo dobivanje
Kemijska svojstva soli i postupci za njihovo dobivanje Amonij je donor-akceptor interakcija ion
Amonij je donor-akceptor interakcija ion Molarna masa amonijaka, svojstva, primjena
Molarna masa amonijaka, svojstva, primjena
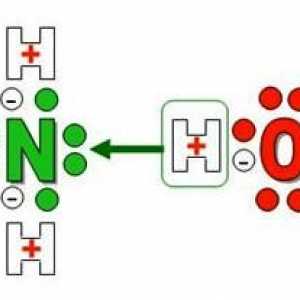 Voda od amonijaka: priprema, formula, primjena
Voda od amonijaka: priprema, formula, primjena Formula amonijaka. Amonijev hidroksid je vodena otopina amonijaka
Formula amonijaka. Amonijev hidroksid je vodena otopina amonijaka Dvostruke soli: primjeri i nazivi
Dvostruke soli: primjeri i nazivi Soli ugljika amonijaka: opis, sastav, opseg primjene
Soli ugljika amonijaka: opis, sastav, opseg primjene Hidroliza: molekularna i ionska jednadžba. Jednadžba reakcije hidrolize
Hidroliza: molekularna i ionska jednadžba. Jednadžba reakcije hidrolize