Faza ravnoteže. Pravilo faze Gibbsa
Danas je fizika postala vrlo uobičajena znanost. U doslovnom smislu, on je posvuda prisutan. Najodemeljniji primjer: u vašem dvorištu raste stablo jabuka, a na njemu se pjeva, dolazi vrijeme i jabuke počinju padati, ali u kojem smjeru padaju? Zahvaljujući zakonu univerzalne gravitacije, naše voće pada na zemlju, tj. Silazi, ali ne prema gore. To je bio jedan od najpoznatijih primjera fizike, ali obratiti pažnju na termodinamiku, točnije na faze ravnoteže, koje nisu manje važne u našem životu.
sadržaj
termodinamika

Prvo, pogledajmo ovaj pojam. Theta-epsilon-rho-mu-omicron-delta-upsilon-nu-a-mu-iota-kappa-ili- tako izgleda riječ na grčkom. Prvi dio Theta-epsilon-rho-mu-o označava "toplinu", a drugi delta-upsilon-nu-alfa-mu-iota-kappa-ili- "moć". Termodinamika je grana fizike koja proučava svojstva makroskopskog sustava, kao i različite načine pretvaranja i prijenosa energije. U ovom su odjeljku posebno proučena različita stanja i procesi, kako bi se opis pojave temperature uvrstio u opis (to je fizička veličina koja karakterizira termodinamički sustav i mjeri se pomoću određenih instrumenata). Svi procesi koji se javljaju u termodinamičkim sustavima opisani su samo mikroskopskim količinama (tlak i temperatura, kao i koncentracija komponenata).
Clapeyron-Clausiusova jednadžba
Svaki fizičar zna ovu jednadžbu, ali analizirati ga u dijelovima. To se odnosi na ravnotežne procese prijelaza određene materije iz jedne faze u drugu. To se može jasno vidjeti u takvim primjerima: topljenje, isparavanje, sublimacija (jedan od načina očuvanja proizvoda koji prolazi kroz potpuno uklanjanje vlage). Formula jasno pokazuje procese koji se odvijaju:
- n = PV / RT;
- gdje T je temperatura tvari;
- P je tlak;
- R je specifična toplina faznog prijelaza;
- V je promjena u određenom volumenu.
Povijest jednadžbe

Clapeyron-Clausius jednadžba je izvrsno matematičko objašnjenje drugog zakona termodinamike. Također se nazivaju "Clausius nejednakost". Naravno, teorem je razvio i sam znanstvenik koji je želio objasniti odnos između toplinskog toka u sustavu i entropije, kao i njezin okoliš. Ova jednadžba Clausius razvila se u nastojanjima da objasni entropiju i određuje ga u količinama. U doslovnom smislu, teorem nam omogućuje utvrditi je li ciklički proces reverzibilan ili nepovratan. Ova nejednakost nudi nam kvantitativnu formulu za razumijevanje drugog zakona.
Znanstvenik je bio jedan od prvih koji je radio na ideji entropije, pa čak i dao taj proces ime. Ono što je sada poznato kao Clausiusov teorem prvi put je objavljeno 1862. godine u Rudolfovom šesti rad "O upotrebi ekvivalentnog teorema za transformacije za rad u unutrašnjosti". Znanstvenik je pokušao pokazati proporcionalni odnos između entropije i protoka energije zagrijavanjem (delta- P) u sustavu. U konstrukciji toplinska energija može se pretvoriti u rad i može se pretvoriti u toplinu kroz ciklički proces. Rudolph je dokazao da "algebarska suma svih transformacija koje se događaju u cikličkom procesu može biti samo manja od nule ili, u ekstremnim slučajevima, nula".
Zatvoreni izolirani sustav

Izolirani sustav je jedno od sljedećeg:
- Fizički sustav je daleko od drugih, koji ne stupaju u interakciju s njima.
- Termodinamički sustav je zatvoren čvrstim nepomičnim zidovima, kroz koje ni materija niti energija ne mogu proći.
Unatoč činjenici da se subjekt interno odnosi na vlastitu gravitaciju, izolirani sustav se obično izvodi izvan granica vanjskih gravitacijskih i drugih udaljenih sila.
To se može suprotstaviti onome što se (u općenitijoj terminologiji koja se koristi u termodinamici) naziva zatvorenim sustavom, zatvorenim selektivnim zidovima, kroz koje je moguće prenijeti energiju u obliku topline ili rada, ali nije bitna. I s otvorenim sustavom u koji materija i energija ulaze ili izlaze, iako mogu imati različite neprobojne zidove u dijelovima svojih granica.
Izolirani sustav poštuje zakon o zaštiti. Najčešće se termodinamika, materija i energija tretiraju kao zasebni koncepti.
Termodinamičke prijelaze

Da bismo razumjeli prijelaze kvantne faze, korisno je usporediti ih s klasičnim transformacijama (takozvanim termičkim preokretima). CPT opisuje povratnu točku u termodinamičkim svojstvima sustava. To signalizira reorganizaciju čestica. Tipičan primjer je zamrzavanje prijelaza vode, koja opisuje glatku preobrazbu između tekućine i čvrste tvari. Klasična faza rasta nastaje zbog konkurencije između energije sustava i entropije njegovih toplinskih fluktuacija.
Klasični sustav nema entropiju na nultoj temperaturi i, stoga, fazna transformacija ne može nastati. Njihov red je određen prvim diskontinuiranim izvedenim termodinamičkim potencijalom. I, naravno, ima prvu narudžbu. Faze transformacije od feromagneta do paramagneta su kontinuirane i imaju drugi redoslijed. Ove konstantne promjene iz naređene u neregularnu fazu opisane su parametrom narudžbe koji je nula. Za gore navedenu feromagnetnu transformaciju, parametar redoslijeda bit će ukupna magnetizacija sustava.
Gibbsov potencijal
Besplatna Gibbsova energija je maksimalni broj radova bez ekspanzije koji se mogu ukloniti iz termodinamičkog zatvorenog sustava (koji može izmjenjivati toplinu i raditi s okolinom). Takav maksimalni rezultat može se dobiti samo u potpuno reverzibilnom procesu. Kada sustav obrnuto pretvara iz prve države na drugi, smanjenje Gibbsova slobodna energija jednaka izvršava sustav u svojoj okolini, manje radnih sila tlaka.
Države ravnoteže

Termodinamička i mehanička ravnoteža je aksiomatski koncept termodinamike. Ovo je unutarnje stanje jednog ili više sustava koji su povezani više ili manje propusnim ili nepropusnim zidovima. U tom stanju, ne postoje čisti makroskopski tokovi od materije ili energije, bilo unutar sustava ili između sustava.
U svom vlastitom konceptu stanja unutarnje ravnoteže ne dolazi do makroskopskih promjena. Sustavi se istovremeno nalaze u međusobnim toplinskim, mehaničkim, kemijskim (konstantama), zračenjima ravnoteže. Mogu biti u jednom obliku. U tom procesu, sve vrste se pohranjuju odmah i beskrajnu količinu vremena sve dok se fizička operacija ne prekine. Apsolutno točna uravnotežena razmjena odvija se u makroskopskoj ravnoteži. Gornji dokaz je fizičko objašnjenje ovog koncepta.
temelj
Svaki zakon, teorem, formula ima svoju osnovu. Analizirati smo tri baze zakonitosti faza ravnoteže.
- Faza je oblik tvari, homogeni u kemijskom sastavu, fizičkom stanju i mehaničkoj ravnoteži. Tipične faze su čvrste, tekuće i plinovite. Dvije tekućine koje se ne mogu miješati (ili tekuće mješavine s različitim sastavinama), razdvojene odvojenom granicom, smatraju se dvije različite faze i ne miješaju čvrste čestice.
- Broj komponenti (C) je broj kemijski neovisnih komponenti sustava. Najmanji broj neovisnih vrsta potrebnih za određivanje sastava svih faza sustava.
- Broj stupnjeva slobode (F) u ovom kontekstu je broj intenzivnih varijabli koje međusobno ne ovise.
Razvrstavanje prema faznoj ravnoteži
- Reakcije kontinuiranog čistog prijenosa (koje se često nazivaju reakcije u čvrstoj fazi) pojavljuju se između krutih tvari različitih sastava. Oni mogu uključivati elemente koji se nalaze u tekućinama (H, C), ali ti elementi nastaju u čvrstim fazama, tako da tekuće faze nisu uključene kao reagensi ili proizvodi (H2O, CO2). Čvrste reakcije čistog prijenosa mogu biti kontinuirane ili isprekidane, kao i one s terminalnim.
- Polimorfni su posebni tip reakcije u čvrstoj fazi, što uključuje faze istog sastava. Klasični primjeri su reakcije između aluminij silikata kyanite-sillimanite-andalusite, pretvaranje grafita u dijamant pri visokom tlaku i ravnoteža kalcijevog karbonata.
Zakoni ravnoteže

Gibbsovo tvorničko pravilo predložio je Joseph Willard Gibbs u svom poznatom članku pod naslovom "Ravnoteža heterogenih supstanci", koja je objavljena od 1875. do 1878. godine. Primjenjuje se na ne-reaktivne višekomponentne heterogene sustave u termodinamičkoj ravnoteži i dano je jednako:
- F = C-P + 2;
- gdje F - broj stupnjeva slobode;
- C - broj komponenata;
- P - broj faza u termodinamičkoj ravnoteži jedna s drugom.
Broj stupnjeva slobode je broj nenadziranih intenzivnih varijabli. Najveći broj termodinamički parametri, kao što su temperatura ili tlak, koji se mogu istodobno i proizvoljno razlikovati, bez međusobnog utjecaja. Primjer jednokomponentnog sustava je sustav s jednom čistom kemijskom tvari, a dvokomponentni sustavi, kao što su smjese vode i etanola, imaju dvije neovisne komponente. Tipične fazne prijelaze (fazna ravnoteža) su krutine, tekućine, plinove.
Pravilo faze pri stalnom pritisku

Za primjene u području znanosti o materijalima koji se bave faznim promjenama između različitih čvrstih struktura često postoji stalan pritisak (npr. U jednoj atmosferi) i zanemaruje se kao stupanj slobode, pa pravilo postaje: F = C - P + 1.
Ponekad ući u ovu formulu nazvanu „pravilo s kondenziranom fazi”, ali, kao što znamo, to se ne odnosi na tim sustavima, koji su izloženi visokim tlakovima (npr geologija), jer su efekti tih pritisaka može uzrokovati katastrofalne posljedice.
Može se činiti da je faza ravnoteže - samo fraza, a malo nema fizikalnih procesa koji su uključeni u ovo doba, ali kao što smo vidjeli, bez njega, mnogi zakoni nisu nam poznate, tako da ćemo morati malo upoznati s tim jedinstvenim, šarene, iako Chut malo dosadno pravila. Ovo znanje pomoglo je mnogim ljudima. Oni su naučili kako ih primijeniti na sebe, kao što su električari, znajući pravila faze se mogu zaštititi od nepotrebnog rizika.
 Шоппинг в Греции: конкуренция Милану
Шоппинг в Греции: конкуренция Милану Зеркало сонник и толкование
Зеркало сонник и толкование Carraginan - što je to? Kakva šteta stabilizira karragenan
Carraginan - što je to? Kakva šteta stabilizira karragenan Značenje frazeologije je `Procrustean krevet`. Krilati izraz `Procrustean krevet`
Značenje frazeologije je `Procrustean krevet`. Krilati izraz `Procrustean krevet` Nadbiskup je važan crkveni poredak
Nadbiskup je važan crkveni poredak Греческие цифры и их взаимосвязь с буквами
Греческие цифры и их взаимосвязь с буквами Termodinamika i prijenos topline. Metode prijenosa topline i proračuna. Prijenos topline je ...
Termodinamika i prijenos topline. Metode prijenosa topline i proračuna. Prijenos topline je ... Fizika: koja klasa počinje? Ono što se podučava u nastavi fizike
Fizika: koja klasa počinje? Ono što se podučava u nastavi fizike Termodinamika je ... Definicija, zakoni, aplikacije i procesi
Termodinamika je ... Definicija, zakoni, aplikacije i procesi Značenje riječi "obilje". Obilje je ...
Značenje riječi "obilje". Obilje je ... Osnovne formule molekularne fizike
Osnovne formule molekularne fizike Što fizika proučava
Što fizika proučava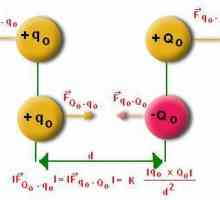 Električni dipolski. Fizika, 10 klasa. elektrodinamika
Električni dipolski. Fizika, 10 klasa. elektrodinamika Zašto trebate fiziku? Ideje za pisanje, a ne samo. Upravo o kompleksu
Zašto trebate fiziku? Ideje za pisanje, a ne samo. Upravo o kompleksu Frazaologija "Alpha i Omega": značenje, podrijetlo, analogije, sinonimi
Frazaologija "Alpha i Omega": značenje, podrijetlo, analogije, sinonimi Molekularna fizika
Molekularna fizika Što je fizika? Njegova uloga u procesu ljudskog razvoja
Što je fizika? Njegova uloga u procesu ljudskog razvoja Rad u termodinamici
Rad u termodinamici Kemijska termodinamika: osnovni pojmovi, zakoni, problemi
Kemijska termodinamika: osnovni pojmovi, zakoni, problemi Sinteza ATP-a: svojstva ovog procesa
Sinteza ATP-a: svojstva ovog procesa Što je paradigma? Značenje i koncept
Što je paradigma? Značenje i koncept
 Carraginan - što je to? Kakva šteta stabilizira karragenan
Carraginan - što je to? Kakva šteta stabilizira karragenan Značenje frazeologije je `Procrustean krevet`. Krilati izraz `Procrustean krevet`
Značenje frazeologije je `Procrustean krevet`. Krilati izraz `Procrustean krevet` Nadbiskup je važan crkveni poredak
Nadbiskup je važan crkveni poredak Греческие цифры и их взаимосвязь с буквами
Греческие цифры и их взаимосвязь с буквами Termodinamika i prijenos topline. Metode prijenosa topline i proračuna. Prijenos topline je ...
Termodinamika i prijenos topline. Metode prijenosa topline i proračuna. Prijenos topline je ... Fizika: koja klasa počinje? Ono što se podučava u nastavi fizike
Fizika: koja klasa počinje? Ono što se podučava u nastavi fizike Termodinamika je ... Definicija, zakoni, aplikacije i procesi
Termodinamika je ... Definicija, zakoni, aplikacije i procesi Značenje riječi "obilje". Obilje je ...
Značenje riječi "obilje". Obilje je ... Osnovne formule molekularne fizike
Osnovne formule molekularne fizike