Struktura atoma. Energetske razine atoma. Protoni, neutroni, elektroni
Ime "atom" prevedeno je s grčkog kao "nedjeljivo". Sve oko nas - krute tvari, tekućine i zrak - izgrađene su od milijarde tih čestica.
sadržaj

Pojava verzije o atomu
Prvi put, atomi su postali poznati u 5. stoljeću prije Krista, kada je grčki filozof Democritus sugerirao da se materija sastoji od pomicanja sićušnih čestica. Ali onda nije bilo načina da provjerimo verziju svog postojanja. I iako nitko nije mogao vidjeti te čestice, raspravljalo se o ideji, jer samo tako znanstvenici mogu objasniti procese koji se odvijaju u stvarnom svijetu. Stoga su vjerovali u postojanje mikročestica mnogo prije vremena kada su bili u stanju dokazati tu činjenicu.
Samo u XIX stoljeću. počeli su se analizirati kao najmanji sastojci kemijskih elemenata koji imaju specifična svojstva atoma - mogućnost spajanja spojeva s drugima u strogo propisanu količinu. Početkom XX. Stoljeća vjerovalo se da su atomi minimalne čestice materije dok se ne dokazuje da se sastoje od još manjih jedinica.

Koji je kemijski element?
Atomi kemijskog elementa su mikroskopski građevni blok materije. Odlučujući faktor ove mikročestice je molekularna masa atoma. Samo otkriće periodičkog zakona Mendelejeva opravdano je da njihova vrsta predstavlja različite oblike pojedine stvari. Tako su male da se ne mogu vidjeti pomoću konvencionalnih mikroskopa, samo najsnažnijih elektroničkih uređaja. Za usporedbu, kosa na čovjeku je milijun puta širi.
Elektronička struktura atoma ima jezgru koja se sastoji od neutrona i protona, kao i elektrona koji se okreću oko središta u stalnim orbiti, poput planeta oko njihovih zvijezda. Svi su pričvršćeni elektromagnetskom silom, jednom od četiri glavna u svemiru. Neutroni su čestice s neutralnim nabojem, protoni su pozitivni i elektroni - negativni. Potonji se privlače pozitivno nabijenim protonom, tako da oni imaju tendenciju da ostanu u orbiti.

Struktura atoma
U središnjem dijelu nalazi se jezgra koja ispunjava minimalni dio cijelog atoma. No, istraživanja pokazuju da gotovo cijela masa (99,9%) se nalazi u njemu. Svaki atom sadrži protone, neutrone, elektrone. Broj rotirajućih elektrona u njoj jednak je pozitivnom središnjem punjenju. Čestica s istim punjenja jezgre Z, ali različite atomske mase A i broju neutrona u jezgri nazivaju N izotope i isto A i različiti Z i N - izobare. Elektronička - minimalna tvar čestica s negativnom električnom naboju e = 1,6middot-10-19 coulombs. Ionsko punjenje određuje količinu izgubljenih ili dodanih elektrona. Postupak metamorfoze neutralan atom u nabijen ion naziva ionizacija.

Nova verzija atomskog modela
Fizičari su otkrili do danas mnoge druge elementarne čestice. Elektronička struktura atoma ima novu verziju.
Vjeruje se da su protoni i neutroni, bez obzira na to koliko su maleni, sastojati od najmanjih čestica, nazvanih kvarkama. Oni predstavljaju novi model za izgradnju atoma. Kako su rani znanstvenici prikupili dokaze o postojanju prethodnog modela, tako da danas pokušavaju dokazati postojanje kvarkova.
RTM - uređaj budućnosti
Moderni znanstvenici mogu vidjeti na monitoru računala atomske čestice materije, kao i da ih se kreće po površini pomoću posebnog alata, koji se zove skeniranje tuneliranje mikroskop (RTM).
Ovo je kompjutorizirani Alat s vrhom koji se kreće vrlo oprezno u blizini površine materijala. Kada se vrh pomiče, elektroni se kreću kroz prazninu između vrha i površine. Iako materijal izgleda sasvim glatko, zapravo je neravnomjeran na atomskoj razini. Računalo stvara kartu površine tvari, stvarajući sliku njegovih čestica, a znanstvenici, dakle, mogu vidjeti svojstva atoma.
Radioaktivne čestice
Negativno nabijeni ioni cirkuliraju oko jezgre na dovoljno velikoj udaljenosti. Struktura atoma je takva da je cjelina stvarno neutralna i nema električni naboj, jer su sve čestice (protoni, neutroni, elektroni) u ravnoteži.
Radioaktivni atom je element koji se lako može slomiti. Njezino središte sastoji se od mnogih protona i neutrona. Izuzetak je samo dijagram vodikovog atoma koji ima jedan proton. Jezgra je okružena oblakom elektrona, to je njihova atrakcija koja ga čini okretati oko središta. Protoni se odbijaju jedni s istim nabojem.
Ovo nije problem za većinu malih čestica koje imaju nekoliko. No, neki od njih su nestabilni, posebno za one velike veličine, poput urana, koji ima 92 protona. Ponekad njegov centar ne podnosi takvo opterećenje. Oni se nazivaju radioaktivnim jer bacaju nekoliko čestica iz jezgre. Nakon što je nestabilna jezgra oslobodila protona, ostatak je nova kći. Može biti stabilna ovisno o broju protona u novoj jezgri i može se podijeliti dalje. Ovaj proces traje do postojanja stabilnog kernela djeteta.
Svojstva atoma
Fizičko-kemijska svojstva atoma prirodno variraju od jednog do drugog elementa. Odredeni su sljedećim osnovnim parametrima.
Atomska masa. Budući da glavno mjesto mikročestice zauzima protoni i neutroni, zbroj ih se određuje brojem izraženim u jedinicama atomske mase (amu). Formula: A = Z + N.
Atomsko polumjer. Polumjer ovisi o mjestu elementa u Mendelejevom sustavu, kemijskoj vezi, broju susjednih atoma i kvantno-mehaničkom učinku. Polumjer jezgre je sto tisuća puta manji od polumjera samog elementa. Struktura atoma može izgubiti elektrone i pretvoriti se u pozitivni ion ili dodati elektrone, te postati negativni ion.
U periodički sustav Mendelejev svaki kemijski element zauzima svoje mjesto. U tablici se veličina atoma povećava pri kretanju od vrha prema dnu i smanjuje se pri pomicanju s lijeva na desno. Nakon toga, najmanji element je helij, a najveći element je cezij.
Valencija. Vanjska elektronska školjka atoma naziva se valencija, a elektroni u njemu prikladno nazivaju valentni elektroni. Njihov broj određuje kako atom kombinira s ostatkom kemijskim vezama. Metoda stvaranja potonjih mikročestica pokušava popuniti svoje vanjske valentne ljuske.
Gravitacija, atrakcija je sila koja drži planete u orbiti, zbog toga, predmeti koji se oslobađaju iz ruke pada na pod. Osoba više primjećuje gravitaciju, ali elektromagnetna akcija je mnogo puta moćnija. Sila koja privlači (ili odbija) nabijene čestice u atomu je 1.000.000.000.000.000.000.000.000.000.000.000.000.000 puta jači od gravitacije u njemu. No, u središtu jezgre postoji još snažna sila koja može držati protone i neutrone zajedno.
Reakcije u jezgrama stvaraju energiju u oba nuklearna reaktora, gdje su atomi podijeljeni. Što je teži element, više se atoma gradi od više čestica. Ako dodamo ukupni broj protona i neutrona u elementu, znamo njezinu masu. Na primjer, Uran, najteži element dostupan u prirodi, ima atomsku masu od 235 ili 238.

Fisija atoma u razine
Razine energije atom je veličina prostora oko jezgre, gdje je elektron u pokretu. Ukupno ima 7 orbita koji odgovaraju broju razdoblja u periodičnoj tablici. Što je udaljeniji od mjesta elektrona iz jezgre, to je značajnija energetska rezerva koju posjeduje. Broj razdoblja označava broj atomske orbite oko svoje jezgre. Na primjer, kalij je element četvrtog razdoblja, tako da ima 4 energetske razine atoma. Broj kemijskog elementa odgovara njenoj naboju i broju elektrona oko jezgre.
Atom - izvor energije
Vjerojatno najpoznatija znanstvena formula otkrila je njemački fizičar Einstein. Ona tvrdi da masa nije ništa više od oblika energije. Temeljem ove teorije, energiju možete pretvoriti u energiju i izračunati po formuli koliko se može dobiti. Prvi praktični rezultat ove transformacije bili su atomske bombe, koje su prvo testirane u pustinji Los Alamos (SAD), a potom su eksplodirale nad japanskim gradovima. I iako je samo sedmi dio eksploziva pretvorio u energiju, destruktivna sila atomske bombe bila je strašna.
Kako bi nukleus mogao osloboditi svoju energiju, mora se urušiti. Da bi se podijelio, potrebno je djelovati na vanjskoj strani neutrona. Tada se jezgra raspada na još dvije, lakše, osiguravajući ogromnu energiju. Propadanje dovodi do oslobađanja drugih neutrona, a oni i dalje razdvoje druge jezgre. Proces se pretvara u lančanu reakciju, što dovodi do velike količine energije.
Pro i kontra korištenju nuklearne reakcije u naše vrijeme
Destruktivna sila koja se oslobađa u transformaciji materije, čovječanstvo pokušava ukrotiti nuklearne elektrane. Ovdje se nuklearna reakcija ne odvija u obliku eksplozije, već kao postupnog vraćanja topline.

Proizvodnja nuklearne energije ima svoje prednosti i nedostatke. Prema znanstvenicima, kako bi se održala naša civilizacija na visokoj razini, potrebno je koristiti ovaj ogroman izvor energije. No, treba uzeti u obzir i činjenicu da ni najnapredniji razvoj ne može jamčiti potpunu sigurnost nuklearnih elektrana. Osim toga, dobivena u procesu proizvodnje energije radioaktivni otpad s nepravilnim pohranjivanjem može utjecati na naše potomke deseci tisuća godina.
Nakon nesreće u Černobilu, sve više ljudi smatra da je proizvodnja nuklearne energije vrlo opasna za čovječanstvo. Jedina sigurna elektrana ove vrste je Sunce s nuklearnom energijom ogromne snage. Znanstvenici razvijaju sve vrste modela solarnih ćelija, a možda, u skoroj budućnosti, čovječanstvo će moći pružiti sigurnu nuklearnu energiju.
 Što je elektron? Svojstva i povijest otkrivanja elektrona
Što je elektron? Svojstva i povijest otkrivanja elektrona Struktura atoma: što je neutron?
Struktura atoma: što je neutron? Što je subatomska čestica?
Što je subatomska čestica? Razina energije atoma: struktura i prijelazi
Razina energije atoma: struktura i prijelazi Koja elementarna čestica ima pozitivan naboj?
Koja elementarna čestica ima pozitivan naboj? Planetarni model Rutherforda, atom u modelu Rutherford
Planetarni model Rutherforda, atom u modelu Rutherford Struktura atoma. Kvantno-mehanički model atoma
Struktura atoma. Kvantno-mehanički model atoma Atomska jezgra. Otkrivanje tajni
Atomska jezgra. Otkrivanje tajni Najmanja električno neutralna čestica kemijskog elementa: sastav, struktura, svojstva
Najmanja električno neutralna čestica kemijskog elementa: sastav, struktura, svojstva Osnovne informacije o strukturi atoma: karakteristike, značajke i formula
Osnovne informacije o strukturi atoma: karakteristike, značajke i formula Struktura atoma
Struktura atoma Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme
Tko je predložio nuklearni model strukture atoma? Nuklearni model atomske strukture i sheme Što je atom promjera? Veličina atoma
Što je atom promjera? Veličina atoma Struktura materije
Struktura materije Proton naboj je osnovna vrijednost fizike elementarnih čestica
Proton naboj je osnovna vrijednost fizike elementarnih čestica Iskustvo Rutherforda
Iskustvo Rutherforda Molekularna fizika
Molekularna fizika Rutherfordovi eksperimenti
Rutherfordovi eksperimenti Ukratko o kompleksu: struktura školjaka atoma elektrona
Ukratko o kompleksu: struktura školjaka atoma elektrona Planetarni model atoma: teorijsko opravdanje i praktični dokazi
Planetarni model atoma: teorijsko opravdanje i praktični dokazi Što se sastoji od atoma bilo koje tvari?
Što se sastoji od atoma bilo koje tvari?

 Struktura atoma: što je neutron?
Struktura atoma: što je neutron? Što je subatomska čestica?
Što je subatomska čestica? Razina energije atoma: struktura i prijelazi
Razina energije atoma: struktura i prijelazi Koja elementarna čestica ima pozitivan naboj?
Koja elementarna čestica ima pozitivan naboj? Planetarni model Rutherforda, atom u modelu Rutherford
Planetarni model Rutherforda, atom u modelu Rutherford Struktura atoma. Kvantno-mehanički model atoma
Struktura atoma. Kvantno-mehanički model atoma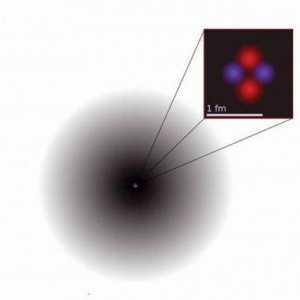 Najmanja električno neutralna čestica kemijskog elementa: sastav, struktura, svojstva
Najmanja električno neutralna čestica kemijskog elementa: sastav, struktura, svojstva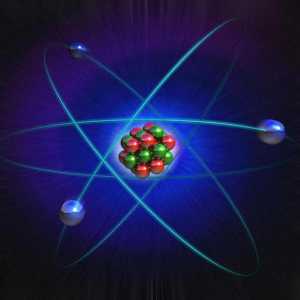 Osnovne informacije o strukturi atoma: karakteristike, značajke i formula
Osnovne informacije o strukturi atoma: karakteristike, značajke i formula